
【题目】实验室用98%的浓H2SO4(ρ=1.84gcm-3)配制500mL0.2molL-1稀H2SO4溶液,请回答有关问题。
实验步骤 | 有关问题 |
(1)计算所需浓H2SO4,体积为(保留一位小数) | 需要浓H2SO4体积为 _____① mL. |
(2)量取浓H2SO4 | 用 _____② mL量简量取所需浓H2SO4(填“6”、“10”、“50”或“100”) |
(3)在100mL烧杯中稀释浓H2SO4 | 向盛有一定量水的烧杯中沿烧杯内壁慢慢倒入浓H2SO4,并不断搅拌。冷却到室温。 |
(4)将烧杯中的溶液转移至 _____ ③中(填实验仪器); | 玻璃棒的作用是: ____________④ 。 |
(5)并用少量 | 现如下情况,使所配溶液浓度偏高的是_____⑤ A没有进行操作步骤(5); B定容摇匀后,发现液面在刻度线以下,继续加水至刻度线; C容量瓶没干燥,底部有少量蒸馏水; D在定容观察液面时,俯视刻度线; |
(6)轻轻摇匀容量瓶,使溶液混合均匀 | |
(7)将蒸馏水注入容量瓶,液面离容量瓶刻度线下1~2cm ,用胶头滴管向容量瓶中滴加蒸馏水至 刻度线 ,盖好瓶塞,反复上下颠倒,摇匀。 |
【答案】5.4 6 500mL容量瓶 引流 D
【解析】
(1)根据c=1000![]() /M,c浓
/M,c浓![]() V浓=c稀
V浓=c稀![]() V稀进行计算;
V稀进行计算;
(2)根据量筒的选用规则是“大而近”;
(4)移液是将稀释并冷却的溶液用玻璃棒引流至500ml容量瓶中;
(5) 根据c=![]() 进行推导。
进行推导。
(1)根据c=1000![]() /M可知,浓硫酸的浓度c=1000×1.84×98%/98=18.4mol/L,需要的浓硫酸的体积为VL,根据溶液的稀释c浓
/M可知,浓硫酸的浓度c=1000×1.84×98%/98=18.4mol/L,需要的浓硫酸的体积为VL,根据溶液的稀释c浓![]() V浓=c稀
V浓=c稀![]() V稀,则18.4mol/L×VL=0.5L×0.2mol/L,解得V=0.0054L=5.4ml;
V稀,则18.4mol/L×VL=0.5L×0.2mol/L,解得V=0.0054L=5.4ml;
(2)需要的浓硫酸为5.4ml,则根据量筒的选用规则是“大而近”,则选用6ml的量筒;
(4)移液是将稀释并冷却的溶液用玻璃棒引流至500ml容量瓶中;玻璃棒的作业为引流;
(5)A.没有进行操作步骤(5),导致溶质的物质的量减少,配置溶液浓度偏低;
B.定容摇匀后,发现液面在刻度线以下,继续加水至刻度线,会导致溶液的体积偏大,配置溶液浓度偏低;
C.容量瓶没干燥,内壁附有少量蒸馏水,对所配溶液的溶质与溶液的体积无影响,则配置溶液的浓度无影响;
D.在定容观察液面时,俯视刻度线,会导致溶液体积偏小,配置溶液的浓度偏高;
答案为D。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】某同学设计了测定气体摩尔体积的探究实验,利用氯酸钾分解制O2。

实验步骤如下:
①连接好实验装置,检查装置的气密性。
②把适量的氯酸钾粉末和少量二氧化锰粉末混合均匀,放入干燥的试管中,准确称量试管和药品的总质量为15.95 g。
③加热,开始反应,直到不再有气体产生为止。
④测量排入量筒中水的体积为285.0 mL,换算成标准状况下氧气的体积为279. 7 mL。
⑤准确称量试管和残留物的质量为15. 55 g。
根据上述实验过程,回答下列问题:
(1)如何检查装置的气密性?____________________________________________。
(2)以下是测量收集的气体体积必须包括的几个步骤:
①调整量筒的高度使广口瓶和量筒内的液面高度相同;
②使试管和广口瓶内气体都冷却至室温;
③读取量筒内液体的体积。
这三步操作的正确顺序是_________________(请填写步骤代号)。
进行③的实验操作时,若仰视读数,则读取氧气的体积_______(填“偏大”“偏小”或“无影响”)。
(3)实验过程中产生氧气的物质的量是_____mol;实验测得氧气的气体摩尔体积是______(保留小数点后两位)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.根据下列各题中所给出的数据,可分别求出其“溶液的溶质质量分数”或“溶液的物质的量浓度”,试判断并求解。
(1)已知某NaOH溶液V L中含有n个OH-,可求出此溶液的_______为________。
(2)已知某NaOH溶液中Na+与H2O的个数之比为1∶a,则可求出此溶液的_______为_________。
Ⅱ.常温下,10.0 mL 1.0 mol/L的H2SO4溶液,加水稀释到500 mL,所得H2SO4溶液的浓度为________mol/L;蒸发浓缩,使溶液的体积为2.5 mL,所得H2SO4溶液的浓度为______mol/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是中学化学中常用于混合物的分离和提纯的装置,请根据装置回答问题:
(1)从氯化钾溶液中得到氯化钾固体,选择装置____________(填代表装置图的字母,下同);除去自来水中的Cl等杂质,选择装置________。
(2)从碘水中分离出I2,选择装置________,该分离方法的名称为________。
(3)装置A中仪器①的名称是________,装置B中仪器②的名称是________。
(4)为了除去KCl中的Ca2+、Mg2+、SO42-及泥沙,得到纯净的KCl,可将混合物溶于水,然后在下列操作中选取必要的步骤和正确的操作顺序进行提纯,正确的步骤及顺序是___________。
①过滤 ②加过量NaOH溶液 ③加适量盐酸 ④加过量Na2CO3溶液
⑤加过量BaCl2溶液 ⑥加过量KOH溶液 ⑦加过量K2CO3溶液
A.②⑤④①③ B.⑥⑤⑦①③ C.④①②⑤③ D.④②⑤①③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在呼吸面具和潜水艇中可用Na2O2作为供氧剂:
(1)实验室常用加热钠的方法制备Na2O2,Na2O2是_______色固体,实验室制备Na2O2的化学方程式_______,试写出Na2O2与CO2反应的化学方程式________。
(2)现有mg含有Na2O杂质的Na2O2试样。(可供选用的反应物只有CaCO3固体,6molL﹣1 盐酸和蒸馏水)请从如图中选用适当的实验装置,设计一个最简单的实验,测定Na2O2试样的纯度。

请填写下列空白:
①写出实验中Na2O2和Na2O分别发生反应的化学方程式__________、__________。
②应选用的装置的连接顺序应是___________。
③若开始时测得样品的质量为2.0g,反应结束后测得生成气体的体积为224mL(标准状况),计算出试样中Na2O2的纯度为:__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有四种短周期元素,它们的结构、性质等信息如下表所述:
元素 | 结构、性质等信息 |
A | 是短周期中(除稀有气体外)原子半径最大的元素,该元素的某种合金是原子反应堆的导热剂 |
B | B与A同周期,其最高价氧化物的水化物呈两性 |
C | 元素的气态氢化物极易溶于水,可用作制冷剂 |
D | 是海水中除氢、氧元素外含量最多的元素,其单质或化合物也是自来水生产过程中常用的消毒杀菌剂 |
请根据表中信息填写:
(1)A原子的核外电子排布式:____________________________________________________。
(2)B元素在周期表中的位置:________________________________________________;离子半径:B________(填“大于”或“小于”)A。
(3)C原子的电子排布图是__________________,其原子核外有________个未成对电子,能量最高的电子为________轨道上的电子,其轨道呈________形。
(4)D-的结构示意图是________。
(5)B的最高价氧化物对应的水化物与A的最高价氧化物对应的水化物反应的化学方程式为________________________________________________________________________。与D的氢化物的水化物反应的化学方程式为____________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,用滴定管量取一定体积的浓氯水置于锥形瓶中,用NaOH溶液以恒定速度来滴定该浓氯水,根据测定结果绘制出ClO-、ClO3-等离子的物质的量浓度c与时间t的关系曲线如下。下列说法正确的是

A. NaOH溶液和浓氯水可以使用同种滴定管盛装
B. a点溶液中存在如下关系:c(Na+)+c(H+)=c(ClO-)+c(ClO3-)+c(OH-)
C. b点溶液中各离子浓度:c(Na+)>c(Cl-)>c(ClO3-)=c(ClO-)
D. t2~t4,ClO-的物质的量下降的原因可能是ClO-自身歧化:2ClO-=Cl-+ClO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】G是一种药物的中间体,其合成的部分路线如下:
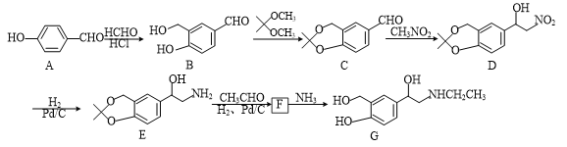
(1)C→D的反应类型是___反应。
(2)化合物F的分子式为C14H21NO3,写出F的结构简式:___。
(3)化合物A与HCHO反应还可能生成的副产物是___。
(4)写出同时满足下列条件的B的一种同分异构体的结构简式:___。
①分子中含有苯环,能与NaHCO3溶液反应;
②含有一个手性碳原子。
(5)根据已有知识并结合相关信息,写出以![]() 、CH3NO2为原料制备
、CH3NO2为原料制备 的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干)。_______________
的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干)。_______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实能用勒夏特列原理来解释的是
A. 实验室采用排饱和食盐水的方法收集氯气Cl2+H2O![]() H++Cl-+HClO
H++Cl-+HClO
B. 工业上合成氨反应N2(g)+ 3H2 (g)![]() 2NH3(g) △H<0 选择500 ℃
2NH3(g) △H<0 选择500 ℃
C. H2、I2、HI平衡混合气体加压后颜色加深H2(g)+ I2(g)![]() 2HI(g)
2HI(g)
D. SO2氧化成SO3,往往需要使用催化剂2SO2(g)+O2(g)![]() 2SO3(g)
2SO3(g)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com