
已知:①Na3N+3H2O=3NaOH+NH3↑,②NaH+H2O=NaOH+H2↑。下列叙述正确的是
A.离子半径:Na+>N3->H+
B.反应①和②都是氧化还原反应
C.反应②每生成1 mol H2,转移的电子数为NA
D.Na3N和NaH与盐酸反应都只生成一种盐
C
【解析】
试题分析:A、离子的核外电子层数越多离子半径越大。在核外电子排布相同的条件下原子序数越大,离子半径越小,则.离子半径:N3->Na+>H+,A不正确;B、有元素化合价发生变化的反应是氧化还原反应,在反应①中元素的化合价均不变化,不是氧化还原反应。反应②中氢元素的化合价发生变化,属于氧化还原反应,B不正确;C、反应②中氢元素的化合价分别从NaH中-1价和水中+1价变化到0价,注意1个电子,所以反应②每生成1 mol H2,转移的电子数为NA,C正确;D、根据反应①可知Na3N与盐酸反应生成氯化钠和氯化铵两种盐,D不正确,答案选C。
考点:考查离子半径比较、氧化还原反应的有关判断与计算


 桃李文化快乐暑假武汉出版社系列答案
桃李文化快乐暑假武汉出版社系列答案 优秀生快乐假期每一天全新寒假作业本系列答案
优秀生快乐假期每一天全新寒假作业本系列答案 暑假接力赛新疆青少年出版社系列答案
暑假接力赛新疆青少年出版社系列答案科目:高中化学 来源: 题型:阅读理解
| D | ||||
| W | ||||
查看答案和解析>>
科目:高中化学 来源: 题型:


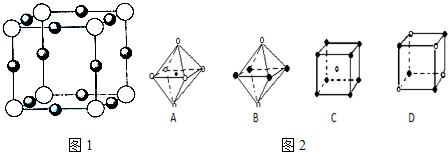
查看答案和解析>>
科目:高中化学 来源: 题型:
 Q、W、X、Y、Z是5种短周期元素,原子序数逐渐增大,Q是周期表中原子半径最小的元素,Q与W组成的化合物是一种温室气体,W与Y、X与Y组成的化合物是机动车排出的大气污染物,Y和Z能形成原子个数比为1:1和1:2的两种离子化合物.
Q、W、X、Y、Z是5种短周期元素,原子序数逐渐增大,Q是周期表中原子半径最小的元素,Q与W组成的化合物是一种温室气体,W与Y、X与Y组成的化合物是机动车排出的大气污染物,Y和Z能形成原子个数比为1:1和1:2的两种离子化合物.

查看答案和解析>>
科目:高中化学 来源: 题型:
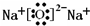
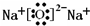
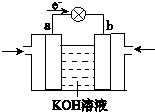
| 1 | 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ① | ② | |||||
| ③ | ④ | ⑤ | ⑥ | ⑦ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com