
【题目】某液态卤代烷RX(R是烷基,X是某种卤素原子)的密度是ag/cm3 ,该RX可以跟稀碱发生水解反应生成ROH(能跟水互溶)和HX。为了测定RX的相对分子质量,拟定的实验步骤如下:
①准确量取该卤代烷 b mL,放入锥形瓶中。②在锥形瓶中加入过量稀NaOH溶液,塞上带有长玻璃管的塞子,加热,发生反应。③反应完成后,冷却溶液,加稀HNO3酸化,滴加过量AgNO3溶液,得白色沉淀。④过滤,洗涤,干燥后称重,得到cg固体。回答下面问题:
(1)装置中长玻璃管的作用是________________________。
(2)步骤④中,洗涤的目的是为了除去沉淀上吸附的__________________离子。
(3)该卤代烷中所含卤素的名称是_____,判断的依据是______________。
(4)该卤代烷的相对分子质量是____________________。(用含a、b、c的代数式表示)
(5)如果在步骤③中加HNO3的量不足,没有将溶液酸化,则步骤④中测得的c值(填下列选项代码)___________。
A.偏大 B.偏小 C.大小不定 D.不变
【答案】防止卤代烃挥发(冷凝回流) Ag+、Na+、NO3- 氯元素 滴加AgNO3 后产生白色沉淀 143.5ab/c A
【解析】
实验原理为:RX+NaOH![]() ROH+NaX,NaX+AgNO3=AgX↓+NaNO3,通过测定AgX的量,确定RX的摩尔质量;
ROH+NaX,NaX+AgNO3=AgX↓+NaNO3,通过测定AgX的量,确定RX的摩尔质量;
(1)因RX(属有机物卤代烃)的熔、沸点较低,加热时易挥发,所以装置中长导管的作用是防止卤代烃挥发(或冷凝回流);
(2)醇ROH虽然能与水互溶,但不能电离,所以沉淀AgX吸附的离子只能是Na+、NO3-和过量的Ag+,洗涤的目的为除去沉淀吸附的离子;
(3)因为所得的AgX沉淀为白色,所以该卤代烷中所含卤素的名称是氯元素;
(4)RCl ~ AgCl
M(RCl) 143.5
ag/ cm3×bmL cg
M(RCl)=143.5ab/c,该卤代烷的相对分子质量是143.5ab/c;
(5)在步骤③中,若加HNO3的量不足,则NaOH会与AgNO3反应生成AgOH沉淀,导致生成的AgX沉淀中因混有AgOH,而使沉淀质量偏大,答案选A。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】(1)如图所示,若C为浓硝酸,电流表指针发生偏转,B电极材料为Fe ,A电极材料为Cu,则B电极的电极反应式为___________,A电极的电极反应式为_______;反应进行一段时间后溶液C的pH将___ (填“升高”“降低”或“基本不变”)。
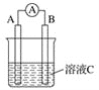
(2)我国首创以铝空气海水电池作为能源的新型的海水标志灯,以海水为电解质溶液,靠空气中的氧气使铝不断氧化而产生电流,只要把灯放入海水数分钟,就会发出耀眼的白光。则电源的负极材料是____,负极反应为___________;正极反应为_____________________________。
(3)熔盐电池具有高的发电效率,因而受到重视,可用Li2CO3和Na2CO3的熔融盐混合物作电解质,CO为负极燃气,空气与CO2的混合气为正极助燃气,制得在650 ℃下工作的燃料电池,完成有关电池反应式。负极反应式为2CO+2CO32--4e-=4CO2,正极反应式为___________,电池总反应式为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在25℃时,将1.0Lwmol·L-1CH3COOH溶液与0.1molNaOH固体混合,充分反应。然后向混合液中加入CH3COOH或CH3COONa固体(忽略体积和温度变化),溶液pH的变化如图所示。下列叙述正确的是( )
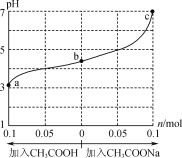
A.b点溶液中:c(Na+)<c(CH3COOH)+c(CH3COO-)
B.由b点到a点的过程中,c(Na+)有可能大于c(CH3COO-)
C.a、b、c对应的混合液中,水的电离程度由大到小的顺序是c>a>b
D.25℃时,Ka(CH3COOH)=![]() mol·L-1
mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“绿色化学实验”已走进课堂,下列做法符合“绿色化学”的是
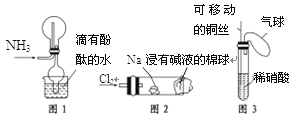
①实验室收集氨气采用图1所示装置
②实验室做氯气与钠的反应实验时采用图2所示装置
③实验室中用玻璃棒分别蘸取浓盐酸和浓氨水做氨气与酸生成铵盐的实验
④实验室中采用图3所示装置进行铜与稀硝酸的反应
A. ②③④B. ①②③C. ①②④D. ①③④
【答案】C
【解析】
分析每种装置中出现的相应特点,再判断这样的装置特点能否达到处理污染气体,减少污染的效果。
①图1所示装置在实验中用带有酚酞的水吸收逸出的氨气,防止氨气对空气的污染,符合“绿色化学”,故①符合题意;
②图2所示装置用沾有碱液的棉球吸收多余的氯气,能有效防止氯气对空气的污染,符合“绿色化学”,故②符合题意;
③氨气与氯化氢气体直接散发到空气中,对空气造成污染,不符合防止污染的理念,不符合“绿色化学”,故③不符合题意;
④图3所示装置中,铜丝可以活动,能有效地控制反应的发生与停止,用气球收集反应产生的污染性气体,待反应后处理,也防止了对空气的污染,符合“绿色化学”,故④符合题意;
故符合“绿色化学”的为①②④。
故选C。
【点睛】
“绿色化学”是指在源头上消除污染,从而减少污染源的方法,与“绿色化学”相结合的往往是原子利用率,一般来说,如果所有的反应物原子都能进入指定的生成物的话,原子的利用率为100%。
【题型】单选题
【结束】
17
【题目】为了探究铁及其化合物的氧化性和还原性,某同学设计了如下实验方案,其中符合实验要求且完全正确的是( )
选项 | 实验操作 | 实验现象 | 离子反应 | 实验结论 |
A | 向氯化亚铁溶液中通入氯气 | 浅绿色溶液变成棕黄色溶液 | 2Fe2++Cl2=2Fe3++2Cl- | Fe2+具有还原性 |
B | 在氯化亚铁溶液中加入锌片 | 浅绿色溶液变成无色溶液 | Fe2++Zn=Fe+Zn2+ | Fe2+具有还原性 |
C | 在氯化铁溶液中加入铁粉 | 棕黄色溶液变成浅绿色溶液 | Fe3++Fe=2Fe2+ | 铁单质具有还原性 |
D | 在氯化铁溶液中加入铜粉 | 蓝色溶液变成棕黄色溶液 | 2Fe3++Cu=2Fe2++Cu2+ | Fe2+具有氧化性 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019 年 9 月,我国科研人员研制出 Ti-H-Fe 双温区催化剂,其中 Ti-H 区域和Fe 区域的温度差可超过100℃。Ti-H-Fe双温区催化合成氨的反应历程如图所示,其中吸附在催化剂表面上的物种用*标注。下列说法错误的是
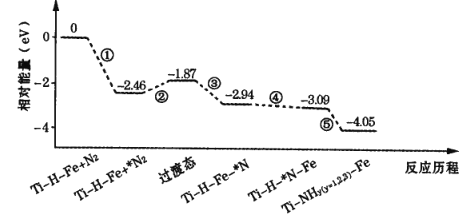
A.①②③在 Fe 区域发生,④⑤在Ti-H区域发生
B.在高温区加快了反应速率,低温区提高了氨的产率
C.该历程中能量变化最大的是2. 46eV,是氮分子中氮氮三键的断裂过程
D.使用 Ti-H-Fe 双温区催化合成氨,不会改变合成氨反应的反应热
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学实验小组的同学为探究和比较SO2和氯水的漂白性,设计了如下的实验装置。
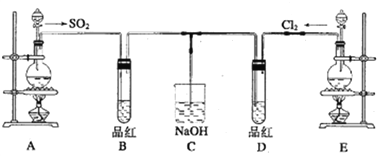
(1)实验室用装置A制备SO2,某同学在实验时发现打开A的分液漏斗活塞后,漏斗中液体未流下,该同学怎样操作可以使分液漏斗液体顺利滴下___________________________;
(2)实验室用装置E制备Cl2,其反应的化学方程式为____________________,若实验室用酸性KMnO4和浓盐酸反应制Cl2,反应的离子方程式为________________________。
(3)反应开始一段时间后,观察到B、D两个试管中的品红溶液都褪色,停止通气后,再给B、D两个试管分别加热;两个试管中的现象分别为:
B:_______________________,D:_________________________。
(4)若将B中品红换成Na2S溶液,通SO2一段时间后B中现象为_____________________。
(5)另一个实验小组的同学认为SO2和氯水都有漂白性,二者混合后的漂白性肯定会更强。他们将制得的SO2和Cl2按1:1同时通入到品红溶液中,结果发现褪色效果并不像想象的那样。请你分析该现象的原因(用化学方程式表示)_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)已知:25 ℃、101 kPa时,C(s)+1/2O2(g)=CO(g) ΔH1=-110.5 kJ/mol
C(s)+O2(g)=CO2(g) ΔH2=-393.5 kJ/mol
试回答下列问题:
①碳的燃烧热是:__________(填“ΔH1”或“ΔH2”);
②CO(g)+1/2O2(g)=CO2(g) ΔH=__________kJ/mol。
(2)在25 ℃时,将0.2 mol NO2充入2 L的密闭容器中,发生反应:2NO2(g)![]() N2O4(g) ΔH=-56.9 kJ/mol。5秒后反应达到平衡,测得NO2的物质的量为0.1 mol。试回答下列问题:
N2O4(g) ΔH=-56.9 kJ/mol。5秒后反应达到平衡,测得NO2的物质的量为0.1 mol。试回答下列问题:
①5秒内,v(NO2)=__________mol/(L·s);
②若将该容器置于冰水中,气体颜色将________(填“变深”“变浅”或“不变”);
③该反应的平衡常数表达式K=________________。
(3)NaHSO3是中学化学常见的物质。HSO3-在水溶液中存在如下两个平衡:
HSO3-=H++SO32- Ka2
HSO3-+H2O=H2SO3+OH- Kh2
已知25 ℃时,Ka2>Kh2,则0.1 mol/L NaHSO3溶液:
①溶液呈__________(填“酸性”“碱性”或“中性”);
②溶液中c(Na+)______c(HSO3-)(填“>”“<”或“=”)。
(4)将除锈后的铁钉用饱和食盐水浸泡一下,放入下图所示的具支试管中。

①几分钟后,可观察到导管中的水柱________;
A.升高 B.降低
②水柱变化的原因是铁钉发生了电化学腐蚀中的________;
A.析氢腐蚀 B.吸氧腐蚀
③该电化学腐蚀的正极反应式为__________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)在①CO2,②NaCl,③Na,④Si,⑤CS2,⑥金刚石,⑦(NH4)2SO4,⑧乙醇中,由极性键形成的非极性分子有_______(填序号,以下同),含有金属离子的物质是__,分子间可形成氢键的物质是________,属于离子晶体的是__,属于原子晶体的是__,①~⑤五种物质的熔点由高到低的顺序是__。
(2)A,B,C,D为四种晶体,性质如下:
A.固态时能导电,能溶于盐酸
B.能溶于CS2,不溶于水
C.固态时不导电,液态时能导电,可溶于水
D.固态、液态时均不导电,熔点为3500 ℃
试推断它们的晶体类型:A.__;B.__;C.__;D.__。
(3)下图中A~D是中学化学教科书上常见的几种晶体结构模型,请填写相应物质的名称:A.__;B.__;C.__D.____。
.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人体血液里 Ca2+的浓度一般采用mg/cm3 来表示。抽取一定体积的血样加适量的草酸钱[(NH4)2C2O4]溶液,可析出草酸钙(CaC2O4)沉淀,将此草酸钙沉淀洗涤后溶于强酸可得草酸(H2C2O4),再用酸性KMnO4溶液与之反应即可测定血液样品中Ca2+的浓度。某研究性学习小组设计如下实验步骤测定血液样品中Ca2+的浓度:

(实验探究一 : 配制酸性KMnO4标准溶液)如图是配制l00mL酸性KMnO4标准溶液的过程示意图 :
(1)请你观察图示判断其中不正确的操作有________________(填序号)。
(2)配置上述溶液,需要使用的玻璃仪器是量筒、烧杯、玻璃棒、_______________(填名称)。
(3)按照图示的操作配制溶液,所得KMnO4标准溶液的浓度将________________(填 偏大 或 偏小 或者 无影响,下同)。如未冷却至室温就进行液体转移,则其所配的氯化钾溶液的浓度_____;若用托盘天平时错把砝码放在左边,把药品放在右边称量,则其所配氯化钾溶液的浓度_______。
(实验探究二:测定血液样品中Ca2+的浓度)抽取血样20.00mL经过上述处理后得到草酸,再用0.020mol/L酸性KMnO4溶液与之反应,使草酸转化成CO2 逸出,这时共消耗12.00mL酸性KMnO4溶液 。
(4)已知草酸跟酸性KMnO4溶液反应的离子方程式为 :2MnO4-+5H2C2O4+6 H+ =2Mnx++l0CO2↑+8H2O 则式中的x=_______。
(5)经过计算,血液样品中Ca2+的浓度为____mg/mL。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com