
| A. | 钡 | B. | 铅 | C. | 碘 | D. | 铁 |
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HF的电子式: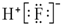 | |
| B. | H、D、T是氢元素的三种不同核素,互称同位素 | |
| C. | K+离子的结构示意图: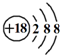 | |
| D. | 溴化钠的电子式: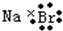 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 请回答:
请回答:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
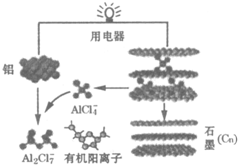
| A. | 放电时,有机阳离子向铝电极方向移动 | |
| B. | 充电时,铝电极连接外加电源的正极,石墨电极连接外加电源的负极 | |
| C. | 放电时负极的电极反应为:Al-3e-+7AlCl4-=4Al2Cl7- | |
| D. | 该电池的工作原理为:3Cn+4Al2Cl7-$?_{充电}^{放电}$3CnAlCl4+Al+AlCl4- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
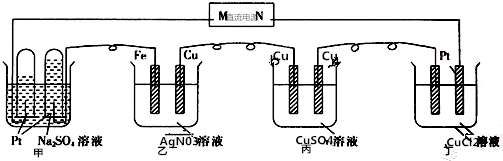
| A. | N为直流电源的正极 | |
| B. | 乙池的总反应为4AgN03+2H20═4Ag+4HNO3+O2↑ | |
| C. | 丙池的反应符合电解精炼铜原理 | |
| D. | 要使丁池电解质溶液复原,需加适量的CuCl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 加入物质 | 现象 | 解释或离子方程式 |
| A | AgNO3溶液 | 有白色沉淀生成 | Cl-+Ag+═AgCl↓ |
| B | 石蕊试液 | 显红色 | 氯水中有盐酸、次氯酸 |
| C | CaCO3 | 有气体放出 | CO32-+2H+═H2O+CO2↑ |
| D | FeCl2和KSCN溶液 | 有红色沉淀生成 | 2Fe2++Cl2═2Fe3++2Cl- |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2种 | B. | 3种 | C. | 4种 | D. | 5种 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com