

| A. | 乙烯和H2生成乙烷的反应△H>0 | |
| B. | 加入催化剂,降低了E活,并减小了反应的△H | |
| C. | 图1表明,催化加氢过程中催化剂参与反应过程并形成不稳定的中间体 | |
| D. | 图2表明,催化加氢过程中催化剂将较难发生的反应分成了多个容易发生的反应,可提高反应物的转化率 |
分析 A.由图可知乙烯和H2生成乙烷的反应为放热反应;
B.加入催化剂,反应热不变;
C.由图可知加入催化剂降低反应的活化能,应生成不稳定的中间体;
D.催化剂不影响平衡移动.
解答 解:A.由图可知乙烯和H2生成乙烷的反应为放热反应,则△H<0,故A错误;
B.由图可知加入催化剂,反应物与生成物的总能量差不变,则反应热不变,故B错误;
C.由图可知加入催化剂降低反应的活化能,应生成不稳定的中间体,可知催化剂参加反应,故C正确;
D.催化剂不影响平衡移动,不能改变转化率,故D错误.
故选C.
点评 本题考查学生反应热的判断、催化剂的特点等知识,为高频考点,侧重考查学生的分析能力,注意知识的归纳和梳理是关键,难度中等.


 新编小学单元自测题系列答案
新编小学单元自测题系列答案 字词句段篇系列答案
字词句段篇系列答案科目:高中化学 来源: 题型:选择题
| A. | 使用催化剂是为了加快反应速率,提高生产效率 | |
| B. | 在上述条件下,SO2不可能100%地转化为SO3 | |
| C. | 为了提高SO2的转化率,应适当提高O2的浓度 | |
| D. | 达到平衡时,SO2的浓度与SO3的浓度相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 CuSO4和Cu(NO3)2是自然界中重要的铜盐.请回答下列问题:
CuSO4和Cu(NO3)2是自然界中重要的铜盐.请回答下列问题: (用箭头表示出配位键的位置)
(用箭头表示出配位键的位置)查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1 mol•L-1的HCOOH溶液中:c(HCOO-)+c(OH-)=c(H+) | |
| B. | 等浓度、等体积的Na2CO3和NaHCO3混合:$\frac{c(HC{O}_{3}^{-})}{c({H}_{2}C{O}_{3})}$>$\frac{c(C{O}_{3}^{2-})}{c(HC{O}_{3}^{-})}$ | |
| C. | 0.1 mol•L-1的NaHCO3溶液中:c(Na+)+c(H+)=c(HCO${\;}_{3}^{-}$)+2c(CO${\;}_{3}^{2-}$)+c(OH-) | |
| D. | 等体积、等物质的量浓度的NaX和弱酸HX混合后的溶液中:c(Na+)>c(HX)>c(X-)>c(H+)>c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 按系统命名法,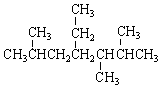 的名称为2,5,6-三甲基-4-乙基庚烷 的名称为2,5,6-三甲基-4-乙基庚烷 | |
| B. | 常压下,正戊烷、异戊烷、新戊烷的沸点依次增大 | |
| C. | 肌醇 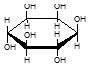 与葡萄糖 与葡萄糖 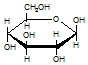 的元素组成相同,化学式均为C6H12O6,满足Cm(H2O)n,因此,均属于糖类化合物 的元素组成相同,化学式均为C6H12O6,满足Cm(H2O)n,因此,均属于糖类化合物 | |
| D. | 1.0 mol的 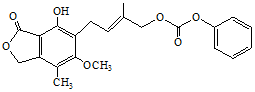 最多能与含5.0 mol NaOH的水溶液完全反应 最多能与含5.0 mol NaOH的水溶液完全反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

| 实验编号 | 操作 | 现象 |
| a | 加入足量氨水,振荡 | 黑色固体不溶解 |
| b | 加入足量稀硝酸,振荡 | 黑色固体溶解,并有气体产生 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 氯碱工业中,X、Y均为石墨,Y附近能得到氢氧化钠 | |
| B. | 铜的精炼中,X是纯铜,Y是粗铜,Z是CuSO4 | |
| C. | 电镀工业中,X是待镀金属,Y是镀层金属 | |
| D. | 外加电流的阴极保护法中,X是待保护金属 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 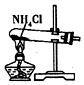 制取氧气 | B. | 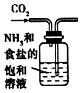 制取NaHCO | C. | 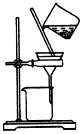 分离NaHCO3 | D. | 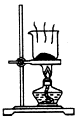 干燥NaHCO |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  和 和 分子组成相差一个-CH2-,因此是同系物关系 分子组成相差一个-CH2-,因此是同系物关系 | |
| B. |  和 和 均是芳香烃, 均是芳香烃, 既是芳香烃又是芳香族化合物 既是芳香烃又是芳香族化合物 | |
| C. | 分子式为C4H8的有机物可能存在4个C-C单键 | |
| D. | 分子式为C4H7ClO2,可与NaHCO3产生CO2的有机物可能结构有5种 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com