
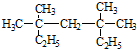 系统命名法为3,3,5,5-四甲基庚烷,
系统命名法为3,3,5,5-四甲基庚烷, ,
,分析 (1)烷烃在命名时,要选最长的碳链为主链,从离支链近的一端给主链上的碳原子编号;
(2)4-甲基-1-戊烯即主链上有5个碳原子,碳碳双键在1号和2号碳原子间,在4号碳原子上有一个甲基;
(3)乙醛和新制氢氧化铜发生氧化还原反应生成乙酸、氧化亚铜和水;
(4)A.制备乙烯,测定反应液的温度;
B.溴苯不易氧化;
C.苯酚易溶于酒精,但银与氨水不反应;
D.醛与氢氧化铜的反应应在碱性条件下.
解答 解:(1)烷烃在命名时,要选最长的碳链为主链,故主链上有7个碳原子,从离支链近的一端给主链上的碳原子编号,则在3号和5号碳原子上各有2个甲基,故名称为:3,3,5,5-四甲基庚烷,故答案为:3,3,5,5-四甲基庚烷;
(2)4-甲基-1-戊烯即主链上有5个碳原子,碳碳双键在1号和2号碳原子间,在4号碳原子上有一个甲基,故结构简式为:CH3CH(CH3)CH2CH=CH2,键线式为: ,故答案为:
,故答案为: ;
;
(3)在加热条件下,乙醛和新制氢氧化铜发生氧化还原反应生成乙酸、氧化亚铜和水,反应方程式为:CH3CHO+2Cu(OH)2$\stackrel{△}{→}$CH3COOH+Cu2O↓+2H2O,
故答案为:CH3CHO+2Cu(OH)2$\stackrel{△}{→}$CH3COOH+Cu2O↓+2H2O,故答案为:CH3CHO+2Cu(OH)2$\stackrel{△}{→}$CH3COOH+Cu2O↓+2H2O;
(4)A.制乙烯时,温度计应插入反应混合液中,测定反应液温度为170℃,故A正确;
B.检验C2H5Cl中氯元素时,将C2H5Cl和NaOH水溶液混合加热,然后用稀硝酸酸化,再加入AgNO3溶液,故B错误;
C.做过银镜反应的试管用硝酸洗涤,做过苯酚的试管用酒精洗涤,因Ag与硝酸反应,苯酚溶于酒精,故C错误;
D.将一定量CuSO4和NaOH溶液混合后加入甲醛溶液,加热未产生砖红色沉淀,醛与氢氧化铜的反应应在碱性条件下,则原因可能是NaOH量太少,故D正确;
故答案为:BC.
点评 本题考查化学实验方案的评价,为高频考点,涉及物质制备、性质以及检验等,侧重实验基本操作和实验原理的考查,注意装置的作用及实验的操作性、评价性分析,题目难度不大.


科目:高中化学 来源: 题型:解答题
| 实验 序号 | 0.01mol/L KIO3酸性溶液 (含淀粉)的体积/mL | 0.01mol/L Na2SO3溶 液的体积/mL | 水的体 积/mL | 实验温 度/℃ | 出现蓝色 的时间/s |
| ① | 5 | 5 | V1 | 0 | |
| ② | 5 | 5 | 40 | 25 | |
| ③ | 5 | V2 | 35 | 25 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 检验试剂 | 预期现象和结论 |
| 装置Ⅲ的试管中加入0.5mol.L-1BaCl2. | 产生大量白色沉淀,证明气体产物中含有SO3. |
| 装置Ⅳ的试管中加入0.01mol.L-1酸性KMnO4溶液(或0.0lmol.L-1溴水). |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+的电子排布图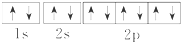 | |
| B. | Na+的结构示意图: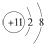 | |
| C. | 基态Na原子的电子排布式:1s22s22p53s2 | |
| D. | 基态Na原子的价电子排布式:3s1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
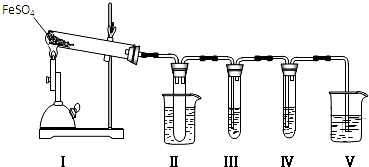
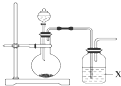 实验室可用浓硫酸和亚硫酸钠固体制备SO2,并验证其相关性质.装置如图所示
实验室可用浓硫酸和亚硫酸钠固体制备SO2,并验证其相关性质.装置如图所示查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | BrCl和NaOH溶液反应生成NaCl、NaBrO两种盐 | |
| B. | BrCl具有较强的氧化性 | |
| C. | 能使润湿的淀粉碘化钾试纸变蓝 | |
| D. | BrCl与水反应中,BrCl既是氧化剂又是还原剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
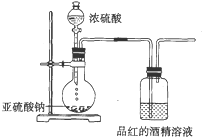 已知氯气的漂白作用实际上是氯气与水反应生成的次氯酸的漂白作用.为了探究SO2的漂白作用到底是SO2本身具有的还是SO2与水作用的产物具有的,某学习小组设计了如图所示的装置来进行实验.请回答相关问题.
已知氯气的漂白作用实际上是氯气与水反应生成的次氯酸的漂白作用.为了探究SO2的漂白作用到底是SO2本身具有的还是SO2与水作用的产物具有的,某学习小组设计了如图所示的装置来进行实验.请回答相关问题.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com