
| A. | 还原剂 | B. | 氧化剂 | C. | 还原产物 | D. | 氧化产物 |
 举一反三同步巧讲精练系列答案
举一反三同步巧讲精练系列答案 口算与应用题卡系列答案
口算与应用题卡系列答案 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案科目:高中化学 来源: 题型:解答题
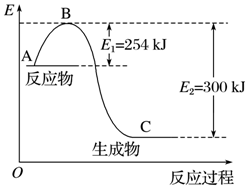 氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用.
氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用.| 化学键 | H-H | N≡N |
| 键能/kJ•mol-1 | 435 | 943 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 滴定次数 | 待测液体积/ml | 标准盐酸体积/ml | |
| 滴定前读数/ml | 滴定后读数/ml | ||
| 第一次 | 10.00 | 0.20 | 22.90 |
| 第二次 | 10.00 | 0.50 | 20.40 |
| 第三次 | 10.00 | 4.00 | 24.10 |
| 第四次 | 10.00 | 0.00 | 20.00 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
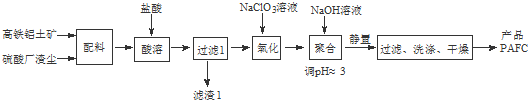
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 做焰色反应实验用的铂丝要用受热容易挥发的稀盐酸洗涤 | |
| B. | 观察K2SO4的焰色应透过蓝色的钴玻璃 | |
| C. | 可以用焰色反应来区别NaCl溶液和KCl溶液 | |
| D. | 焰色反应一定是化学变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
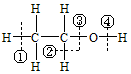 在化学反应中断键位置说法错误的是( )
在化学反应中断键位置说法错误的是( )| A. | 乙醇与钠反应,在④位置断裂,对比钠与水反应,乙醇比水更难电离出氢离子 | |
| B. | 乙醇与浓硫酸在170℃时,在②③位置断裂,以水分子的形式消去,属于消去反应 | |
| C. | 乙醇与浓硫酸在140℃时,在③或④位置断裂,该反应是取代反应 | |
| D. | 乙醇在铜催化下与氧气反应,在②④位置断裂,所以只有与羟基直接相连的碳原子上有氢原子才能发生催化氧化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Z2+2M2+=2 M3++2Z-不可以进行 | |
| B. | Z元素在①②反应中发生还原反应 | |
| C. | 各粒子还原性由强到弱的顺序是X2+>Z->R->M2+ | |
| D. | 各粒子氧化性由强到弱的顺序是XO4->Z2>R2>M3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
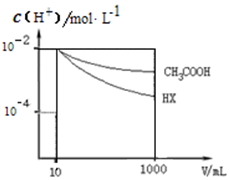 25℃时,三种酸的电离平衡常数如表:
25℃时,三种酸的电离平衡常数如表:| 化学式 | CH3COOH | H2CO3 | HClO |
| 电离平衡常数 | 1.8×10-5 | K1 4.3×10-7 K2 5.6×10-11 | 3.0×10-8 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com