
 n Z (g) +2 W (g)。2 min 末已生成0.2 mol W ,若测知以Z的浓度变化表示的反应速率为0.05 mol·(L·min)-1,计算:
n Z (g) +2 W (g)。2 min 末已生成0.2 mol W ,若测知以Z的浓度变化表示的反应速率为0.05 mol·(L·min)-1,计算:科目:高中化学 来源:不详 题型:单选题
 2C(g)若经 2 s 后测得 C 的浓度为 0.6 mol·L-1 ,现有下列几种说法:
2C(g)若经 2 s 后测得 C 的浓度为 0.6 mol·L-1 ,现有下列几种说法:| A.①③ | B.②③ | C.①④ | D.③④ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.不用稀硫酸,改用98﹪浓硫酸 | B.加入数滴氯化铜溶液 |
| C.加入适量的蒸馏水 | D.加入更多锌片 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.3 mol/L H2 O2溶液 | B.3 mol/L NaOH溶液 |
| C.1 mol/L KClO3溶液 | D.1 mol/L盐酸 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.把石灰石固体研细后与盐酸反应 |
| B.食品放在冰箱中贮藏 |
| C.用MnO2作H2O2分解反应的催化剂 |
| D.铝和烧碱溶液反应时,稍微加热 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 2NH3,
2NH3, 后测得N2的物质的量为0.6mol,则:
后测得N2的物质的量为0.6mol,则:查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.食品放在冰箱中贮藏 |
| B.用铁粉代替铁钉与稀硫酸反应制取氢气 |
| C.合成氨工业中使用催化剂 |
| D.在试管中进行铝和盐酸反应时,稍微加热 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
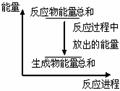
| A.其反应物或生成物都能用来表示该反应的速率 |
| B.反应过程中能量关系可用上图表示 |
| C.若将该反应设计成原电池,锌为负极 |
| D.若设计为原电池,当有32.5g锌溶解,正极放出标况下11.2L气体 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 2SO3(g) ;△H<0。反应过程中A保持恒温、恒容,B保持恒温、恒压,并都达到平衡状态。下列说法中,正确的是
2SO3(g) ;△H<0。反应过程中A保持恒温、恒容,B保持恒温、恒压,并都达到平衡状态。下列说法中,正确的是查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com