



科目:高中化学 来源: 题型:
 如图所示,两圆圈相交的阴影部分甲、乙、丙表示圆圈内物质相互发生的反应,钠及其氧化物的物质的量均为0.1mol,水的质量为100g.下列说法正确的是( )
如图所示,两圆圈相交的阴影部分甲、乙、丙表示圆圈内物质相互发生的反应,钠及其氧化物的物质的量均为0.1mol,水的质量为100g.下列说法正确的是( )| A、甲、乙、丙都属于氧化还原反应 |
| B、丙反应中的氧化剂是Na2O2,还原剂时H2O |
| C、丙反应中消耗1molNa2O2,则转移1mol电子 |
| D、若甲、乙、丙反应后所得溶液的质量分数分别为w1、w2、w3,则:2w1=w2=w3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
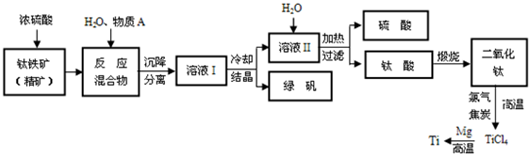
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、饱和碘水和煤油加入分液漏斗中后,塞上口部的塞子,且一手压住分液漏斗口部,一手握住活塞部分,把分液漏斗倒转过来用力振荡 |
| B、静置,待分液漏斗中溶液分层后,先使分液漏斗内外空气相通,以准备放出液体 |
| C、打开分液漏斗的活塞,使全部下层液体沿承接液体的烧杯内壁慢慢流出 |
| D、上层液体在分液漏斗中保存 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 溶液中被沉淀的离子 | Fe3+ | Fe2+ | Cu2+ |
| 完全生成氢氧化物沉淀时,溶液的pH | ≥3.7 | ≥6.4 | ≥4.4 |
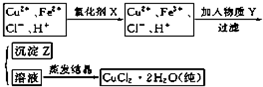
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、石油分馏和煤的干馏都是物理变化 |
| B、棉与蚕丝完全燃烧都只生成CO2和H2O |
| C、淀粉和纤维素水解的最终产物都是葡萄糖 |
| D、鸡蛋清溶液中加入CuSO4溶液会发生盐析 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、CaCl2和Na2CO3 |
| B、稀H2SO4和Na2CO3 |
| C、KOH和Al2(SO4)3 |
| D、HCl NaAlO2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com