
毒重石的主要成分BaCO3(含Ca2+、Mg2+、Fe3+等杂质),实验室利用毒重石制备BaCl2·2H2O的流程如下:
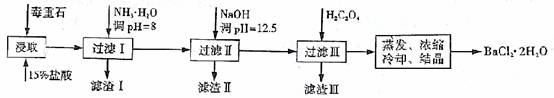
(1)毒重石用盐酸浸取前需充分研磨,目的是 。实验室用37%的盐酸配置15%的盐酸,除量筒外还需使用下列仪器中的 。
a.烧杯 b.容量瓶 c.玻璃棒 d.滴定管
(2)
| Ca2+ | Mg2+ | Fe3+ | |
| 开始沉淀时的pH | 11.9 | 9.1 | 1.9 |
| 完全沉淀时的pH | 13.9 | 11.1 | 3.2 |
加入NH3·H2O调节pH=8可除去 (填离子符号),滤渣Ⅱ中含 (填化学式)。加入H2C2O4时应避免过量,原因是 。
已知:Ksp(BaC2O4)=1.6×10-7,Ksp(CaC2O4)=2.3×10-9
(3)利用简洁酸碱滴定法可测定Ba2+的含量,实验分两步进行。
已知:2CrO42—+2H+=Cr2O72—+H20 Ba2++CrO42—=BaCrO4↓
步骤Ⅰ 移取xml一定浓度的Na2CrO4溶液与锥形瓶中,加入酸碱指示剂,用b mol·L-1盐酸标准液滴定至终点,测得滴加盐酸体积为V0mL。
步骤Ⅱ:移取y mLBaCl2溶液于锥形瓶中,加入x mL与步骤Ⅰ 相同浓度的Na2CrO4溶液,待Ba2+完全沉淀后,再加入酸碱指示剂,用b mol·L-1盐酸标准液滴定至终点,测得滴加盐酸的体积为V1mL。
滴加盐酸标准液时应用酸式滴定管,“0”刻度位于滴定管的 (填“上方”或“下方”)。BaCl2溶液的浓度为 mol·L-1,若步骤Ⅱ中滴加盐酸时有少量待测液溅出,Ba2+浓度测量值将 (填“偏大”或“偏小”)。
【答案】(1)增大接触面积从而使反应速率加快;ac
(2)Fe3+;Mg(OH)2、Ca(OH)2;H2C2O4过量会导致生成BaC2O4沉淀,产品的产量减少。
(3)上方;(V0b—V1b)/y;偏小。
【解析】
试题分析:(1)充分研磨可以增大反应物的接触面积,增大反应速率;因为配制的盐酸溶液浓度为质量分数,可以计算出浓盐酸的体积和水的体积,所以使用烧杯作为容器稀释,玻璃杯搅拌。
(2)根据流程图和表中数据,加入NH3•H2O调pH为8,只有Fe3+完全沉淀,故可除去Fe3+;加入NaOH调pH=12.5,Mg2+也完全沉淀,Ca2+部分沉淀,所以滤渣Ⅱ中含Mg(OH)2、Ca(OH)2;根据Ksp(BaC2O4)=1.6×10-7,H2C2O4过量时Ba2+转化为BaC2O4沉淀,BaCl2·2H2O产品的产量减少。
(3)“0”刻度位于滴定管的上方;与Ba2+反应的CrO42‾的物质的量为(V0b—V1b)/1000mol,则Ba2+浓度为(V0b—V1b)/y;根据计算式,若步骤Ⅱ中滴加盐酸时有少量待测液溅出,V1减小,则Ba2+浓度测量值将偏大。
考点:工艺流程


 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源: 题型:
“茶倍健”牙膏中含有茶多酚,茶多酚是茶叶中多酚类物质的总称,是目前尚不能人工合成的纯天然、多功能、高效能的抗氧化剂和自由基净化剂。其中没食子儿茶素(GC)的结构简式如图所示:
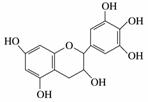
下列关于GC的叙述中正确的是( )
A.分子中所有的原子共面
B.1 mol GC与6 mol NaOH恰好完全反应
C.能发生氧化反应、取代反应、消去反应,难发生加成反应
D.遇FeCl3溶液不发生显色反应
查看答案和解析>>
科目:高中化学 来源: 题型:
高炉炼铁过程中发生的反应: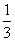 Fe2O3(s)+CO(g)
Fe2O3(s)+CO(g)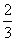 Fe(s)+CO2(g),已知该反应在不同温度下的平衡常数如下表所示,下列说法不正确的是( )
Fe(s)+CO2(g),已知该反应在不同温度下的平衡常数如下表所示,下列说法不正确的是( )
| 温度/℃ | 1 000 | 1 150 | 1 300 |
| 平衡常数 | 4.0 | 3.7 | 3.5 |
A.ΔH<0
B.该反应的平衡常数表达式是K=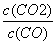
C.其他条件不变,向平衡体系充入CO2气体,K值减小
D.其他条件不变,升高温度,可以降低CO的平衡转化率
查看答案和解析>>
科目:高中化学 来源: 题型:
4.6 g铜镁合金完全溶解于100 mL密度为1.40 g·mL-1、质量分数为63%的浓硝酸中,得到4 480 mL NO2和336 mL N2O4的混合气体(标准状况),向反应的溶液中加入1.0 mol·L-1 NaOH溶液至离子恰好全部沉淀时,下列说法不正确的是( )
A.该合金中铜与镁的物质的量之比是69∶46
B.该浓硝酸中HNO3的物质的量浓度是14.0 mol·L-1
C.产生沉淀8.51 g
D.离子恰好完全沉淀时,加入NaOH溶液的体积是230 mL
查看答案和解析>>
科目:高中化学 来源: 题型:
下列由实验现象得出的结论正确的是:
| 操作及现象 | 结论 | |
| A | 向AgCl悬浊液中加入NaI溶液时出现黄色沉淀。 | Ksp(AgCl)< Ksp(AgI) |
| B | 向某溶液中滴加氯水后再加入KSCN溶液,溶液呈红色。 | 溶液中一定含有Fe2+ |
| C | 向NaBr溶液中滴入少量氯水和苯,振荡、静置,溶液上层呈橙红色。 | Br—还原性强于Cl— |
| D | 加热盛有NH4Cl固体的试管,试管底部固体消失,试管口有晶体凝结。 | NH4Cl固体可以升华 |
查看答案和解析>>
科目:高中化学 来源: 题型:
铁生锈是比较常见的现象,某实验小组为研究铁生锈的条件,设计了以下快速、易行的方法:

首先检查制氧装置的气密性,然后按上图连接好装置,点燃酒精灯给药品加热,持续3分钟左右,观察到的实验现象为:①直形管中用蒸馏水浸过的光亮铁丝表面颜色变得灰暗,发生锈蚀;②直形管中干燥的铁丝表面依然光亮,没有发生锈蚀;③烧杯中潮湿的铁丝表面依然光亮。
试回答以下问题:
(1)由于与金属接触的介质不同,金属腐蚀分成不同类型,本实验中铁生锈属于 。能表示其原理的反应方程式为________________________________________________________________________。
(2)仪器A的名称为 ,其中装的药品可以是 ,其作用是________________________________________________________________________。
(3)由实验可知,该类铁生锈的条件为________________________________________________________________________。
决定铁生锈快慢的一个重要因素是________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
已知室温下BaSO4的Ksp=1.1×10-10,欲使溶液中c(SO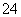 )≤1.0×10-6 mol·L-1,应保持溶液中c(Ba2+)≥__________mol·L-1。
)≤1.0×10-6 mol·L-1,应保持溶液中c(Ba2+)≥__________mol·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
.有Wn+、Xm+、Ym-、Zn-(m>n)四种离子,且W、X、Y、Z四种原子的M电子层中的电子数均为奇数。下列说法中正确的是:
A.Wn+、Xm+、Ym-、Zn-的离子半径依次增大
B.Y、Z的气态氢化物的热稳定性:HmY>HnZ
C.W、X、Y、Z的最高价氧化物对应的水化物都是强电解质
D.W、X、Y、Z的最高价氧化物对应的水化物的碱性依次减弱,酸性依次增强
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com