


分析 (1)①利用复分解反应及MgSO4转化为Mg(OH)2时阴离子的变化来选择试剂;
②利用复分解反应及Mg(OH)2转化为MgCl2时阴离子的变化来选择试剂;
③MgO的熔点高,制备镁一般利用电解熔融的MgCl2;
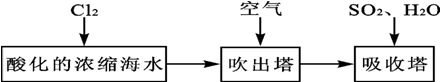
(2)由流程可知,氯气与浓缩海水中溴离子发生氧化还原反应生成溴,在吹出塔中富集溴,然后在吸收塔中溴、二氧化硫和水发生氧化还原反应生成硫酸和HBr;由实验装置可知,a为氯气,可氧化溴离子,热空气可将生成的溴蒸气吹出,气体b为二氧化硫,在B装置中发生氧化还原反应生成硫酸和HBr,C装置为尾气处理装置,吸收氯气、二氧化硫、溴等,以此来解答.
解答 解:(1)①使MgSO4转化为Mg(OH)2,应选择碱,在转化中不引入新的离子,则试剂①选择NaOH,故答案为:NaOH;
②Mg(OH)2转化为MgCl2时,酸能溶解沉淀,由阴离子可知,试剂②可以选用盐酸,故答案为:盐酸;
③MgO的熔点高,不能利用电解或还原法来制备镁,则ABD错误;适宜的冶镁方法是C,故答案为:C;
(2)①要想使溴离子变成溴单质,则加入的a能和溴离子发生反应生成溴单质,氯气能和溴离子发生置换反应生成溴单质,离子反应方程式为Cl2+2Br-=2Cl-+Br2,
故答案为:Cl2+2Br-=2Cl-+Br2;
②溴易挥发,升高温度促进其挥发,所以通入热空气的目的是吹出Br2,故答案为:吹出Br2;
③使溴蒸气转化为氢溴酸以达到富集的目的,可知气体b为SO2,发生的反应为Br2+SO2+2H2O=2HBr+H2SO4,反应过程中,B装置中有SO42-生成.检验SO42-的方法是取少量B装置中反应后的溶液于试管中,滴加氯化钡溶液,产生白色沉淀,证明有SO42-,
故答案为:取少量B装置中反应后的溶液于试管中,滴加氯化钡溶液,产生白色沉淀,证明有SO42-;
④氯气不可能完全反应,氯气和溴离子反应生成溴单质,未反应的二氧化硫、氯气和溴都有毒,不能直接排空,且这几种物质都能和碱反应,所以C装置是尾气处理装置,可知C的作用为吸收未反应的Cl2、Br2和SO2,
故答案为:吸收未反应的Cl2、Br2和SO2.
点评 本题考查镁的制备,明确海水中镁的制备的流程及试剂的选择来分析解答,注意MgO的熔点高是学生解答中易忽略的地方,制备镁利用电解法,题目中等.


科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铝属于ⅢA族元素 | B. | 铝既能溶于酸,又能溶于强碱溶液 | ||
| C. | 在常温下,铝不能与氧气反应 | D. | 铝是地壳中含量最多的金属元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c (Cl-)>c (NH4+)>c (OH-)>c (H+) | B. | c (NH4+)>c (Cl-)>c (OH-)>c (H+) | ||
| C. | c (NH4+)>c (Cl-)>c (H+)>c (OH-) | D. | c (Cl-)>c (NH4+)>c (H+)>c (OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 等物质的量MgCl2、Ba(OH)2和HCl溶液混合:Mg2++3OH-+H+═Mg(OH)2↓+H2O | |
| B. | 由水电离出来的C(OH-)=10-13mol/L的溶液中加入铝粉:2Al+6H+═3H2↑+2Al3+ | |
| C. | 硝酸铁溶液中滴加足量HI溶液:Fe3++3NO3-+12H++10I-═Fe2++5I2↓+3NO↑+6H2O | |
| D. | 用浓盐酸酸化的KMnO4溶液与H2O2反应,证明H2O2具有还原性:2MnO4-+6H++5H2O2═2Mn2++5O2↑+8H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在过氧化钠与水的反应中,每生成1mol氧气,转移电子的数目为1NA | |
| B. | 将0.1mol NaCl全部溶于乙醇中制成胶体,其中含有的胶体粒子数目为0.1NA | |
| C. | 标准状况下,22.4LCCl4含有NA个CCl4分子 | |
| D. | 1 molOD- 含有的质子、中子数均为9NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 17.4g | B. | 46.8g | C. | 40.8g | D. | 23.4g |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 实验室制备1,2-二溴乙烷(无色液体,熔点9℃,密度2.2g•cm-3)的反应原理如下:
实验室制备1,2-二溴乙烷(无色液体,熔点9℃,密度2.2g•cm-3)的反应原理如下:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入银氨溶液,在水浴上加热 | |
| B. | 加入二至三滴紫色石蕊试液 | |
| C. | 先蒸馏,然后对蒸出的物质的水溶液进行银镜反应实验 | |
| D. | 先加入足量的NaOH溶液,然后蒸馏,对蒸出的物质的水溶液进行银镜反应实验 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com