
 如表为元素周期表的一部分,请参照元素①~⑧在表中的位置,用化学用回答下列问题:
如表为元素周期表的一部分,请参照元素①~⑧在表中的位置,用化学用回答下列问题:
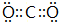 ,故答案为:NaClO;
,故答案为:NaClO;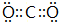 ;
; ,
, ;
;

 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| A、只表示氯化钡与硫酸铜的反应 |
| B、表示氢氧化钡与硫酸铜的反应 |
| C、表示可溶性钡盐与可溶性硫酸盐溶液这一类型的反应 |
| D、只表示可溶性钡盐与可溶性硫酸盐的反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| Ⅰ | Ⅱ | Ⅲ | Ⅳ | Ⅴ | Ⅵ | Ⅶ | 0 | |
| 2 | ① | ② | ③ | ④ | ||||
| 3 | ⑤ | ⑥ | ⑦ | |||||
| 4 | ⑧ | ⑨ | ⑩ |
查看答案和解析>>
科目:高中化学 来源: 题型:

| 氢氧化物 | Al(OH)3 | Mg(OH)2 | Fe(OH)3 | Fe(OH)2 |
| 开始沉淀的pH | 3.10 | 8.54 | 2.01 | 7.11 |
| 完全沉淀的pH | 4.77 | 11.04 | 3.68 | 9.61 |
查看答案和解析>>
科目:高中化学 来源: 题型:
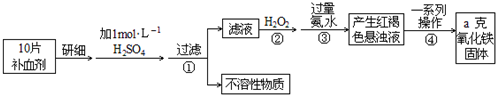
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验操作 | 答案 | 实验现象 |
| ①让一束光线通过Fe(OH)3胶体 | A、呈蓝色 B、生成白色胶状沉淀 C、呈现光亮“通路” D、产生红褐色沉淀 | |
| ②向盛有FeCl3溶液的试管中加入NaOH溶液 | ||
| ③向Al2(SO4)3溶液中滴加氨水 | ||
| ④向土豆片上滴加碘水 |

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com