
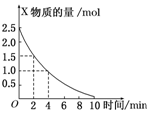
 在容积为3L的密闭容器中,放入气态物质X和Y在一定条件下发生反应2X+Y═2Z,如图所示是该反应中X的物质的量随时间变化的曲线.
在容积为3L的密闭容器中,放入气态物质X和Y在一定条件下发生反应2X+Y═2Z,如图所示是该反应中X的物质的量随时间变化的曲线.分析 (1)2min时X的物质的量为1.5mol,初始物质的量为2.5mol,根据v=$\frac{\frac{△n}{V}}{△t}$计算出2min内用X表示的平均速率;
(2)2min时X的物质的量为1.0mol,初始物质的量为2.5mol,根据v=$\frac{\frac{△n}{V}}{△t}$计算出4min内用X表示的平均反应速率.
解答 解:(1)2min时X的物质的量为1.5mol,X的物质的量变化为:2.5mol-1.5mol=1mol,2min内用X表示的平均速率为:v(B)=$\frac{\frac{1mol}{3L}}{2min}$=$\frac{1}{6}$mol/(L•min),
故答案为:$\frac{1}{6}$mol/(L•min);
(2)4min时X的物质的量为1.0mol,X的物质的量变化为:2.5mol-1.0mol=1.5mol,4min内用X表示的平均速率为:v(B)=$\frac{\frac{1.5mol}{3L}}{4min}$=0.125mol/(L•min),
故答案为:0.125mol/(L•min).
点评 本题考查了化学反应速率的计算,题目难度不大,正确分析图象曲线变化的含义为解答关键,注意掌握化学反应速率的概念及表达式,试题培养了学生的化学计算能力.


 星级口算天天练系列答案
星级口算天天练系列答案 芒果教辅达标测试卷系列答案
芒果教辅达标测试卷系列答案科目:高中化学 来源:2016-2017学年河北省唐山市高二上10月月考化学试卷 (解析版) 题型:选择题
已知4NH3+5O2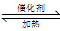 4NO+6H2O,下述化学反应速率关系表述正确的是( )
4NO+6H2O,下述化学反应速率关系表述正确的是( )
A.4v(NH3) =5v(O2) B.5v(O2)=5v(H2O)
C.2v(NH3)=3v(H2O) D.4v(O2)=5v(NO)
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
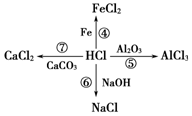 请写出②④⑤⑦的化学方程式,并注明反应类型:
请写出②④⑤⑦的化学方程式,并注明反应类型:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入铝粉有大量氢气产生的溶液中:Ca2+、K+、NO3-、C1- | |
| B. | PH=0的无色溶液中:Na+、K+、MnO4-、NO3- | |
| C. | 在0.1mol/L的醋酸溶液中:Fe2+、Na+、ClO-、Ca2+ | |
| D. | 在c(OH-)=1×10-13的溶液中:NH4+、Ca2+、C1-、K+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 从海水中可以得到NaCl电解熔融NaCl可制备金属钠 | |
| B. | 海水蒸发制海盐的过程中不涉及化学变化 | |
| C. | 从海水中提溴、碘、镁单质,都利用了氧化还原反应 | |
| D. | 利用潮汐发电是将化学能转化为电能 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
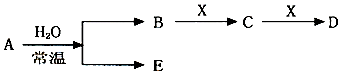
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 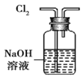 用装置除去Cl2中含有的少量HCl气体 | |
| B. | 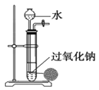 用装置制取少量O2时,能做到“随开随停” | |
| C. | 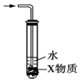 若装置中X为CCl4,则可用于吸收NH3或HCl | |
| D. |  用装置比较氯、碳、硅三种元素的非金属性强弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2CH3CH2OH+O2$→_{△}^{催化剂}$2CH3CHO+2H2O | |
| B. | CH4+2O2$\stackrel{点燃}{→}$CO2+2H2O | |
| C. | CH3CH=CH2+Br2→CH3CHBrCH2Br | |
| D. | CHCl3+HF→CHFCl2+HCl |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
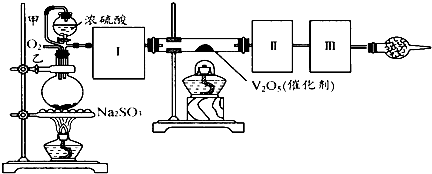

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com