
| A、甲基橙呈红色的溶液中:MnO4-、Al3+、C2H5OH、SO42- | ||
B、常温下的溶液:
| ||
| C、O.1 mol/L AgNO3溶液:H+、K+、SO42-、I- | ||
| D、加入苯酚显紫色的溶液:K+、NH4+、Cl-、I- |
| Kw |
| c(H+) |
| Kw |
| c(H+) |


 新思维假期作业寒假吉林大学出版社系列答案
新思维假期作业寒假吉林大学出版社系列答案科目:高中化学 来源: 题型:
| A、钙和镁 | B、镁和铜 |
| C、铝和镁 | D、锌和铁 |
查看答案和解析>>
科目:高中化学 来源: 题型:
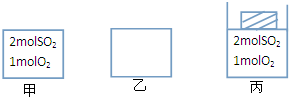 如图所示,甲、乙均为容积1L的恒容容器,丙为恒压容器.
如图所示,甲、乙均为容积1L的恒容容器,丙为恒压容器.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、SiO2是酸性氧化物,不与任何酸反应 |
| B、物质的量浓度相同的Na2SiO3和Na2CO3溶液,其PH值前者大于后者 |
| C、高温时SiO2和Na2CO3反应放出CO2,说明硅酸的酸性比碳酸强 |
| D、水玻璃敞口存放,会有沉淀析出 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、NaHSO3与Na2SO3混合溶液中一定存在如下关系:2c(Na+)=3(c(HSO3-)+c(SO32-)+c(H2SO3)) |
| B、向0.1mol?L-1的醋酸钠溶液中滴加0.1mol?L-1盐酸至中性,所得溶液中:c (Na+)>c (CH3COO-)>c (Cl-)=c (CH3COOH)>c(H+)=c(OH-) |
| C、等物质的量浓度等体积的NH4HSO4和NaOH溶液混合:c(Na+)=c(SO42-)>c(NH4+)>c(H+)>c(OH-) |
| D、向1.00 L 0.3mol?L-1NaOH溶液中缓慢通入0.2molCO2气体,溶液中:c(Na+)>c(CO32-)>c(HCO3-)>c(OH-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、把白炽灯换成节能灯 |
| B、利用太阳能和风能替代化石燃料 |
| C、鼓励购买小排量汽车,推广电动、混合动力汽车 |
| D、利用煤粉气化制备合成气技术,将煤变成合成气(一氧化碳及氢气总量≥90%) |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com