
【题目】已知Kb(NH3·H2O)=1.7×10-5,Ka(CH3COOH)=1.7×10-5。25℃时,向20mL浓度均为0.01mol·L-1的盐酸和醋酸的混合溶液中逐滴加入0.01mol·L-1的氨水,测定过程中电导率和pH变化曲线如图所示,下列说法错误的是
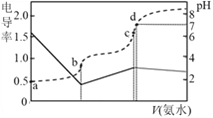
A. a点溶液中,c(CH3COO-)数量级约为10-5
B. b点溶液中,c(NH4+) > c(CH3COOH)
C. c点溶液中,c(NH4+) +c(NH3·H2O) = c(Cl-)+c(CH3COO-)+c(CH3COOH)
D. c点水的电离程度小于d点
【答案】D
【解析】分析:氨水逐滴滴入盐酸和醋酸的混合液中,依次发生的反应为:HCl+NH3·H2O=NH4Cl、CH3COOH+NH3·H2O=CH3COONH4+H2O;盐酸为强酸,随着氨水的滴入,溶液的体积变大,溶液中离子浓度变小,溶液的电导率逐渐变小,当盐酸恰好完全反应时电导率最小,b点为等浓度的NH4Cl和CH3COOH的混合液;继续滴加氨水,弱酸醋酸与氨水反应生成强电解质CH3COONH4,溶液中离子浓度变大,溶液的电导率又逐渐变大,c点为等浓度的NH4Cl和CH3COONH4的混合液;醋酸恰好完全反应后,继续滴加氨水,氨水属于弱碱水溶液,溶液中离子浓度又变小,溶液的导电率又变小。A项,由CH3COOH的电离平衡常数、盐酸和醋酸的浓度计算;B项,b点为等浓度的NH4Cl和CH3COOH的混合液,根据NH3·H2O的Kb计算NH4+的水解平衡常数,比较NH4+的水解平衡常数与CH3COOH的Ka;C项,c点为等浓度的NH4Cl和CH3COONH4的混合液,根据物料守恒判断;D项,分析c点和d点溶液的组成,根据酸、碱、盐对水的电离平衡的影响判断。
详解:氨水逐滴滴入盐酸和醋酸的混合液中,依次发生的反应为:HCl+NH3·H2O=NH4Cl、CH3COOH+NH3·H2O=CH3COONH4+H2O;盐酸为强酸,随着氨水的滴入,溶液的体积变大,溶液中离子浓度变小,溶液的电导率逐渐变小,当盐酸恰好完全反应时电导率最小,b点为等浓度的NH4Cl和CH3COOH的混合液;继续滴加氨水,弱酸醋酸与氨水反应生成强电解质CH3COONH4,溶液中离子浓度变大,溶液的电导率又逐渐变大,c点为等浓度的NH4Cl和CH3COONH4的混合液;醋酸恰好完全反应后,继续滴加氨水,氨水属于弱碱水溶液,溶液中离子浓度又变小,溶液的导电率又变小。A项,a点没有滴入氨水,盐酸为强酸,醋酸为弱酸,醋酸的电离方程式为CH3COOH![]() CH3COO-+H+,设溶液中c(CH3COO-)=xmol/L,则溶液中c(H+)=(0.01+x)mol/L,c(CH3COOH)=(0.01-x)mol/L,Ka(CH3COOH)=
CH3COO-+H+,设溶液中c(CH3COO-)=xmol/L,则溶液中c(H+)=(0.01+x)mol/L,c(CH3COOH)=(0.01-x)mol/L,Ka(CH3COOH)=![]() =
=![]() =1.7
=1.7![]() 10-5,由于HCl电离的H+抑制CH3COOH的电离,0.01+x
10-5,由于HCl电离的H+抑制CH3COOH的电离,0.01+x![]() 0.01,0.01-x
0.01,0.01-x![]() 0.01,解得x
0.01,解得x![]() 1.7
1.7![]() 10-5,c(CH3COO-)的数量级约为10-5,A项正确;B项,根据上述分析,b点为等浓度的NH4Cl和CH3COOH的混合液,NH4Cl属于强酸弱碱盐,NH4+的水解离子方程式为NH4++H2O
10-5,c(CH3COO-)的数量级约为10-5,A项正确;B项,根据上述分析,b点为等浓度的NH4Cl和CH3COOH的混合液,NH4Cl属于强酸弱碱盐,NH4+的水解离子方程式为NH4++H2O![]() NH3·H2O+H+,NH4+的水解平衡常数Kh(NH4+)=
NH3·H2O+H+,NH4+的水解平衡常数Kh(NH4+)=![]() =KW/Kb(NH3·H2O)=1
=KW/Kb(NH3·H2O)=1![]() 10-14
10-14![]() (1.7
(1.7![]() 10-5)=5.88
10-5)=5.88![]() 10-10
10-10![]() Ka(CH3COOH),NH4+的水解程度小于CH3COOH的电离程度,b点溶液中c(NH4+)
Ka(CH3COOH),NH4+的水解程度小于CH3COOH的电离程度,b点溶液中c(NH4+)![]() c(CH3COOH),B项正确;C项,根据上述分析,c点为等浓度的NH4Cl和CH3COONH4的混合液,溶液中的物料守恒为c(NH4+)+c(NH3·H2O)=c(Cl-)+c(CH3COO-)+c(CH3COOH),C项正确;D项,c点为等浓度的NH4Cl和CH3COONH4的混合液,NH4Cl、CH3COONH4水解促进水的电离,d点为等浓度的NH4Cl、CH3COONH4和略过量的氨水组成的混合液,过量的氨水对水的电离起抑制作用,c点水的电离程度大于d点,D项错误;答案选D。
c(CH3COOH),B项正确;C项,根据上述分析,c点为等浓度的NH4Cl和CH3COONH4的混合液,溶液中的物料守恒为c(NH4+)+c(NH3·H2O)=c(Cl-)+c(CH3COO-)+c(CH3COOH),C项正确;D项,c点为等浓度的NH4Cl和CH3COONH4的混合液,NH4Cl、CH3COONH4水解促进水的电离,d点为等浓度的NH4Cl、CH3COONH4和略过量的氨水组成的混合液,过量的氨水对水的电离起抑制作用,c点水的电离程度大于d点,D项错误;答案选D。


科目:高中化学 来源: 题型:
【题目】下列装置或操作能达到实验目的的是
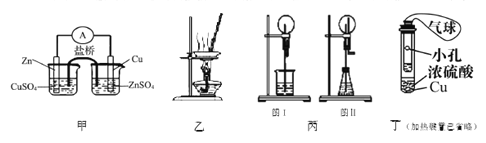
A. 甲装置构成铜锌原电池
B. 用图乙所示装量加热AlCl3饱和溶液然后利用余热蒸干制备AlCl3固体
C. 丙装置里图I烧瓶中充满氨气,烧杯中盛装水,在图II的锥形瓶中,加入足量的Cu与稀硝酸,图I和图II都产生喷泉现象且原理相同
D. 利用丁装置制取SO2,并检验其还原性,小试管中的试剂可为酸性KMnO4溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二价铬不稳定,极易被氧化。醋酸亚铬水合物[Cr(CH3COO)2]2.2H2O,是一种深红色晶体,微溶于乙醇,不溶于冷水和乙醚。实验室以锌粒、CrCl3溶液、醋酸钠溶液和盐酸为主要原料制备醋酸亚铬水合物,其装置如图所示:
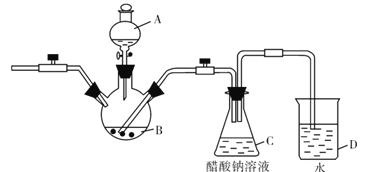
请回答下列问题:
(1)仪器A的名称是______,所盛装的试剂是_______。
(2)该实验中锌粒需过量,其原因除了与CrCl3充分反应得到CrCl2外,另一个作用是 ___________。
(3)写出C容器中制备醋酸亚铬水合物的离子方程式_______。
(4)仪器D的主要作用是_______。
(5)指出该装置的不足之处_______。
(6)Cr(OH)3的性质类似氢氧化铝,将CrCl3溶液蒸干灼烧,所得固体物质的化学式为_____。
(7)洗涤产品时,为了除去可溶性的杂质和水分,下列试剂正确使用的顺序是____(填序号)。
a.无水乙醇 b.冷的蒸馏水 c.乙醚
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物K是有机光电材料中间体。由芳香族化合物A制备K的合成路线如下:
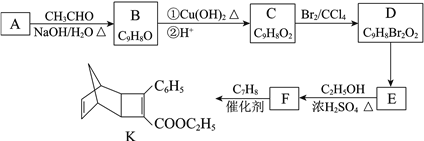
已知:
![]()
![]()
回答下列问题:
(1)A的结构简式是________。
(2)B中官能团是_________、________。
(3)D转化为E的反应类型是________。
(4)由E生成F的化学方程式是________。
(5)C7H8的结构简式是________。
(6)芳香族化合物X是F的同分异构体,该分子中除苯环外,不含其他环状结构,其苯环上只有1种化学环境的氢。X能与饱和碳酸氢钠溶液反应放出CO2,写出符合上述要求的X的结构简式:________。
(7)以环戊烷和2-丁炔为原料制备化合物![]() ,写出有关物质的结构简式(其他试剂任选)。
,写出有关物质的结构简式(其他试剂任选)。
![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图为有机物M、N、Q的转化关系,有关说法正确的是
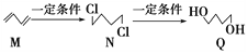
A. M生成N的反应类型是取代反应
B. N的同分异构体有6种
C. 可用酸性KMnO4溶液区分N与Q
D. 0.3 mol Q与足量金属钠反应生成6.72L H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Fe和Fe2O3的混合物共13.6g,加入150mL稀H2SO4,在标准状况下收集到1.12LH2,Fe和Fe2O3均无剩余。为中和过量的H2SO4,并使Fe元素全部转化为Fe(OH)2沉淀,消耗了200mL 3mol/L的NaOH溶液,则该H2SO4的物质的量浓度为
A. 2.25mol/L B. 2mol/L C. 4mol/L D. 0.6mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某天然氨基酸M是人体必需的氨基酸之一,其合成路线如下:
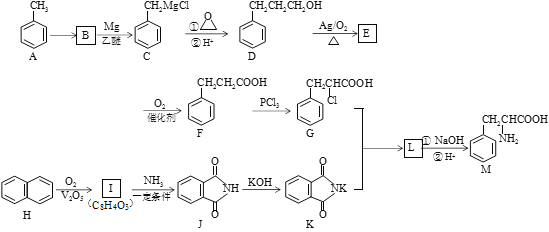
已知: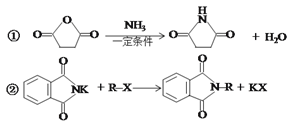
(1)A→B的反应条件和试剂是______________;化合物M的名称为________________;
(2)I→J的反应类型是______________;J分子中最多有_________个原子共平面;
(3)写出D→E反应的化学方程式________________________________________;
(4)I与乙二醇反应可生成能降解的高分子化合物N,写出该反应的化学方程式___________;
(5)符合下列条件的化合物M的同分异构体共有__________种(不考虑立体异构);
①含有苯甲酸结构 ②含有一个甲基 ③苯环上只有两个取代基
其中核磁共振氢谱峰面积比为1:1:2:2:2:3的分子的结构简式________________(任写一种);
(6)请结合以上合成路线,写出以丙酸和上述流程中出现的物质为原料经三步合成丙氨酸(![]() )的路线。____________________________________________________
)的路线。____________________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,向100mL 0.01mol·L-1的NaHA溶液中分别加入浓度均为0.01mol·L-1的NaOH溶液和盐酸,混合溶液的pH随所加溶液体积的变化如图所示(忽略过程中的体积变化)。下列说法不正确的是
A. 25℃时,H2A的第二步电离平衡常数约为10-6
B. 水的电离程度:N>M>P
C. 随着盐酸的不断滴入,最终溶液的pH小于2
D. P点时溶液中存在:2c(H2A)+c(HA-)+c(H+)=c(OH-)+c(Na+)+c(Cl-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒容密闭容器中通入X并发生反应:2X(g)![]() Y(g),温度T1、T2下X的物质的量浓度c(X)随时间t变化的曲线如图所示,下列叙述正确的是
Y(g),温度T1、T2下X的物质的量浓度c(X)随时间t变化的曲线如图所示,下列叙述正确的是
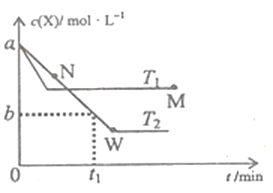
A. M点的正反应速率υ正小于N点的逆反应速率υ逆
B. T2下,在0~t1时间内,υ(Y)=![]() mol/(L·min)
mol/(L·min)
C. M点时再加入一定量X,平衡后X的转化率减小
D. 该反应进行到M点放出的热量小于进行到W点放出的热量
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com