
 .
. +O2$→_{△}^{Cu}$
+O2$→_{△}^{Cu}$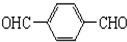 +2H2O.
+2H2O. .(原子量:Ag--108)
.(原子量:Ag--108)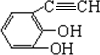 (只写出一种即可).
(只写出一种即可). 分析 (1)2mol羟基能够与钠反应生成1mol氢气,据此判断该有机物分子中含有羟基的数目;
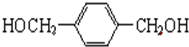
(2)核磁共振H谱显示A有3个峰,峰面积之比为1:2:2,芳香族化合物A分子式为C8H10O2,说明A分子具有对称结构,在苯环的对位C上各含有1个-CH2;
(3)醇羟基能够催化氧化生成醛基或羧基,结合B的相对分子质量比A小4可知B为中含有两个醛基;
(4)根据关系式-HCO~2Ag计算出生成银的物质的量及质量,将生成的有机物C为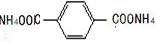 ;
;
(5)B为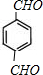 ,有机物F是有机物B的一种同分异构体.1mol F与足量钠反应同样生成氢气22.4L,说明F含有2个羟基,则还应有C≡C键.
,有机物F是有机物B的一种同分异构体.1mol F与足量钠反应同样生成氢气22.4L,说明F含有2个羟基,则还应有C≡C键.
解答 解:(1)标准状况下22.4L氢气的物质的量为:$\frac{22.4L}{22.4L/mol}$=1mol,生成1mol氢气需要消耗2mol-OH,A分子中含有羟基的数目为:$\frac{2mol}{1mol}$=2,
故答案为:2;
(2)芳香族化合物A分子式为C8H10O2,其不饱和度为:$\frac{8×2+2-10}{2}$=4,1个苯环的不饱和度为4,说明A分子中不含有其它不饱和结构;核磁共振H谱显示A有3个峰,峰面积之比为1:2:2,说明A分子具有对称结构,在苯环的对位C上各含有1个-CH2,则A的结构简式为: ,
,
故答案为: ;
;
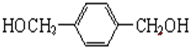
(3)A的结构简式为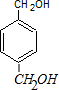 ,A在Cu催化下可被氧气氧化生成有机物B,B的相对分子质量比A小4,则B分子中含有两个醛基,B的结构简式为:
,A在Cu催化下可被氧气氧化生成有机物B,B的相对分子质量比A小4,则B分子中含有两个醛基,B的结构简式为: ,该反应的化学方程式为:
,该反应的化学方程式为: +O2$→_{△}^{Cu}$
+O2$→_{△}^{Cu}$ +2H2O,
+2H2O,
故答案为: +O2$→_{△}^{Cu}$
+O2$→_{△}^{Cu}$ +2H2O;
+2H2O;
(4)1mol B( )与足量银氨溶液充分反应生成有机物C,则C的结构简式为
)与足量银氨溶液充分反应生成有机物C,则C的结构简式为 ,根据关系式-HCO~2Ag可知,1molB分子中含有2mol醛基,能够置换出4molAg,置换出的银的质量为:108g/mol×4mol=432g,反应的方程式为
,根据关系式-HCO~2Ag可知,1molB分子中含有2mol醛基,能够置换出4molAg,置换出的银的质量为:108g/mol×4mol=432g,反应的方程式为 ,
,
故答案为:432; ;
;
(5)B为 ,有机物F是有机物B的一种同分异构体.1mol F与足量钠反应同样生成氢气22.4L,说明F含有2个羟基,则还应有C≡C键,则对应的同分异构体为
,有机物F是有机物B的一种同分异构体.1mol F与足量钠反应同样生成氢气22.4L,说明F含有2个羟基,则还应有C≡C键,则对应的同分异构体为 等,故答案为:
等,故答案为: .
.
点评 本题考查了有机推断,为高考常见题型,明确常见有机物结构与性质为解答关键,注意掌握同分异构体的书写原则,明确常见有机物分子式、结构简式确定方法,试题知识点较多,充分考查了学生的分析能力及灵活应用能力,难度中等.


 同步轻松练习系列答案
同步轻松练习系列答案 课课通课程标准思维方法与能力训练系列答案
课课通课程标准思维方法与能力训练系列答案科目:高中化学 来源: 题型:选择题
| A. | ①②③⑤ | B. | ①③⑤⑥ | C. | ①③④⑦ | D. | ①③⑤⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 饱和Na2CO3溶液 | B. | NaOH稀溶液 | C. | 饱和Ca(OH)2溶液 | D. | CaCl2溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
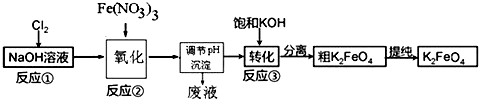
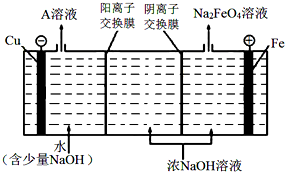
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Zn 粒与稀硫酸反应制取氢气 | |
| B. | 二氧化碳与氢氧化钠溶液反应生成碳酸钠 | |
| C. | 氧化铁在高温下与一氧化碳反应 | |
| D. | 碳酸钠溶液与石灰乳混合 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com