
����Ŀ������ָ����ѧ��Ӧ�����ӷ���ʽ��ȷ����
A. �������̺�Ũ���Ṳ�ȣ� MnO2 +4HCl![]() Mn2++2Cl��+Cl2����2H2O
Mn2++2Cl��+Cl2����2H2O
B. AlCl3��Һ�еμӹ�����Ũ��ˮ��Al3+��4NH3��H2O��AlO![]() ��4NH4+��2H2O
��4NH4+��2H2O
C. ��Cu2O��ϡHNO3��ϣ�3Cu2O��14H����2NO![]() ===6Cu2+��2NO����7H2O
===6Cu2+��2NO����7H2O
D. ��̼�������Һ�м�������ʯ��ˮ��Ca2++HCO3��+OH����CaCO3��+H2O
���𰸡�C
��������A. �������̺�Ũ���Ṳ�ȣ�Ҫ�����ӷ��ű�ʾHCl�� MnO2 +4H��+2Cl��![]() Mn2++Cl2����2H2O����A����B. AlCl3��Һ�еμӹ�����Ũ��ˮ��Al(OH)3�����ڰ�ˮ��Al3++3NH3��H2O
Mn2++Cl2����2H2O����A����B. AlCl3��Һ�еμӹ�����Ũ��ˮ��Al(OH)3�����ڰ�ˮ��Al3++3NH3��H2O![]() Al(OH)3��+3
Al(OH)3��+3![]() ����B����C. ��Cu2O��ϡHNO3��ϣ�3Cu2O��14H����2NO
����B����C. ��Cu2O��ϡHNO3��ϣ�3Cu2O��14H����2NO![]() ===6Cu2+��2NO����7H2O����C��ȷ��D. ��̼�������Һ�м�������ʯ��ˮ�������ﻹ��һˮ�ϰ���Ca2++
===6Cu2+��2NO����7H2O����C��ȷ��D. ��̼�������Һ�м�������ʯ��ˮ�������ﻹ��һˮ�ϰ���Ca2++![]() +HCO3��+2OH����CaCO3��+ NH3��H2O +H2O����D����ѡC��
+HCO3��+2OH����CaCO3��+ NH3��H2O +H2O����D����ѡC��


 ��������״Ԫ��ϵ�д�
��������״Ԫ��ϵ�д� �ƸԿ�����ҵ��ϵ�д�
�ƸԿ�����ҵ��ϵ�д� ��Ԫ����ĩ��ϰ�ȷ��ϵ�д�
��Ԫ����ĩ��ϰ�ȷ��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Ԥ���¹ڷ����У���ѧ��������������Ҫ���ã����²�����������������������
A.84����ҺB.75%�ƾ�C.����D.H2O2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѭ�����ղ���������SO2���ͻ�����Ⱦ��ͬʱ�����Ƶ������������������£�

����˵����ȷ����
A. �������е����ʷ������Ϊ����
B. Ĥ��Ӧ���У�����ѹǿ���������HI�ķֽ����ʺ�ƽ��ת����
C. �ù�����I2��HI���ת������������ѭ����
D. ��ѭ�����յ��ܷ�ӦΪ2SO2+4H2O+I2 == H2+2H2SO4+ 2HI
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и�����Һ��ͨ��������������,ʹ��Һ����������ǿ���� ( )
A. ������ͨ������NH3 B. ������ͨ������NH3
C. ��ˮ�м�������H2O D. �����м�������AgNO3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ���¶��£�10mL 0.40mol/L H2O2��Һ�������ֽ⣬��ͬʱ�̲������O2�������������Ϊ��״�������±���
t/min | 0 | 2 | 4 | 6 | 8 | 10 |
V��O2��/mL | 0.0 | 9.9 | 17.2 | 22.4 | 26.5 | 29.9 |
������������ȷ���ǣ���Һ����仯���Բ��ƣ��� ��
A.0��6 min��ƽ����Ӧ���ʣ�v��H2O2����3.3��10��2 mol/��Lmin��
B.6��10 min��ƽ����Ӧ���ʣ�v��H2O2����3.3��10��2 mol/��Lmin��
C.��Ӧ��6 minʱ��H2O2�ֽ���50%
D.��Ӧ��6 minʱ��c��H2O2��=0.30 mol/L
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������X��һ�ֻ�ͪ�������м��壬��ṹ��ʽ��ͼ��ʾ�������йػ�����X��˵����ȷ����

A. ���л������ʽΪC24H22O5
B. �ܷ���ȡ����Ӧ���ӳɷ�Ӧ��������Ӧ
C. 1mol������X�������2mol NaOH��Ӧ
D. 1mol������X������11mol H2�����ӳɷ�Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��A��B��C��D��E��F����Ԫ�ط������������ڣ���ԭ��������������A��Dͬ���壬���γ����ӻ�����X��B���⻯����F���⻯��ɷ�Ӧ�������ӻ�����Y����B�ĵ����ǿ����к�����ߵ����ʣ�Cԭ�ӵ����������Ǵ�����������3����D��E��F 3��ԭ������㹲��11�����ӣ�����3��Ԫ�ص�����������ˮ�����������ܷ�����Ӧ�����κ�ˮ��
��1��BԪ�ص������� �� B���ʵĽṹʽΪ ��
��2���õ���ʽ��ʾ������X���γɹ��� ��
��3��������Y�ĵ���ʽΪ �� A2C2�ĵ���ʽΪ ��
��4��D��F����������ˮ����֮�䷴Ӧ�����ӷ���ʽΪ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Ӧ4NH3��g��+5O2��g��4NO��g��+6H2O��g���������ܱ������н���1���Ӻ�NH3������0.12mol����ƽ��ÿ����Ũ�ȱ仯��ȷ���ǣ� ��
A.NO 0.001 molL��1
B.H2O 0.002 molL��1
C.NH3 0.002 molL��1
D.O2 0.0025 molL��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ���Ϊ2L�ĺ��º����ܱ������г���һ������H2��N2��������Ӧ:N2(g)+ 3H2(g) ![]() 2NH3(g) ��H=a kJmol-1����ϵ����������ʵ�����ʱ��ı仯��ͼ��ʾ��
2NH3(g) ��H=a kJmol-1����ϵ����������ʵ�����ʱ��ı仯��ͼ��ʾ��
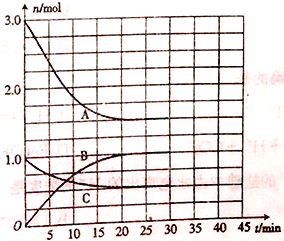
��1����ʾN2Ũ�ȱ仯��������________(����A���� B������C��)��25minʱ,c(NH3)= ______��
��2��0~20min����v(H2)= ______�����ù����з�Ӧ�ų�������Ϊ47.2kJ����a=______��
��3��30minʱ�����������ٳ���һ������NH3��һ��ʱ�����ԭ��ѧƽ��״̬ʱ�ķ�Ӧ������ȣ�����Ӧ����______������� ��С�����䡱����ͬ�����淴Ӧ����_______________��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com