
同素异形体相互转化的反应热相当小而且转化速率较慢,有时还很不完全,测定反应热很困难。现在可根据盖斯提出的“不管化学过程是一步完成或分几步完成,这个总过程的热效应是相同的”观点来计算反应热。已知:
P4(白磷,s)+5O2(g)===P4O10(s) ΔH1=-2 983.2 kJ·mol-1①
P(红磷,s)+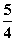 O2(g)===
O2(g)===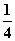 P4O10(s) ΔH2=-738.5 kJ·mol-1②
P4O10(s) ΔH2=-738.5 kJ·mol-1②
则白磷转化为红磷的热化学方程式为____________________________。相同状况下,能量状态较低的是________;白磷的稳定性比红磷________(填“高”或“低”)。
 口算能手系列答案
口算能手系列答案科目:高中化学 来源: 题型:
按一定的分类方法可将浓硫酸、无水氯化钙、固体氢氧化钠等物质归于同一类物质。现有X物质亦可归于此类物质,但X与固体氢氧化钠有更多相似的性质。则X应该是( )
A.KOH溶液
B.无水硫酸铜
C.氧化钙
D.硝酸钾固体
查看答案和解析>>
科目:高中化学 来源: 题型:
某化学兴趣小组按照下列方案进行“由含铁废铝制备硫酸铝晶体”的实验:
步骤1:取一定量含铁废铝,加足量的NaOH溶液,反应完全后过滤。
步骤2:边搅拌边向滤液中滴加稀硫酸至溶液的pH=8~9,静置、过滤、洗涤。
步骤3:将步骤2中得到的固体溶于足量的稀硫酸。
步骤4: 。
请回答以下问题:
(1)上述实验中的过滤操作需要玻璃棒、 等玻璃仪器。
(2)步骤1发生反应的离子方程式为
过滤的目的是__________________________________________。
(3)当步骤2中的溶液pH=8~9时,检验沉淀是否完全的方法是______________。
(4)步骤2中溶液的pH控制较难操作,可改用____________________,发生反应的离子方程式为 。
(5)步骤4的操作为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
亚氯酸钠(NaClO2)是一种重要的消毒剂。已知:①NaClO2的溶解度随温度升高而增大,适当条件下可结晶析出NaClO2·3H2O,②ClO2的沸点为283K,纯ClO2易分解爆炸,③HClO2在25℃时的电离程度与硫酸的第二步电离程度相当,可视为强酸。如图是过氧化氢法生产亚氯酸钠的工艺流程图:
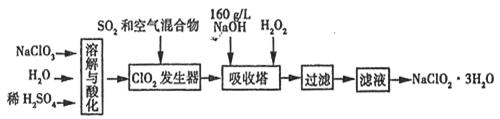
(1)C1O2发生器中所发生反应的离子方程式为 ,发生器中鼓入空气的作用可能是 (选填序号)。
A.将SO2氧化成SO3增强酸性 B.稀释C1O2以防止爆炸
C.将NaClO3氧化成C1O2
(2)在该实验中用质量浓度来表示NaOH溶液的组成,若实验时需要450ml
l60g/L的NaOH溶液,则在精确配制时,需要称取NaOH的质量是 g,
所使用的仪器除托盘天平、量筒、烧杯、玻璃棒外,还必须有
(3) 吸收塔内的温度不能超过20℃,其主要目的是 _,吸收塔内发生反应的化学方程式为 。
(4)在吸收塔中,可代替H2O2的试剂是 (填序号)。
A.Na2O2 B.Na2S C.FeCl2 D.KMnO4
(5)从滤液中得到NaClO2·3H2O晶体的实验操作依次是 (填操作名称)
A.蒸馏 B.蒸发浓缩 C.灼烧 D.过滤 E、冷却结晶
查看答案和解析>>
科目:高中化学 来源: 题型:
某实验小组用工业上废弃固体(主要成分Cu2S和Fe2O3)混合物制取粗铜和Fe2(SO4)3晶体,设计的操作流程如下:
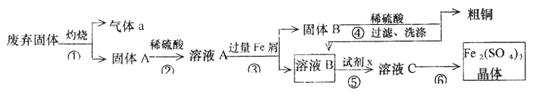
(1)除酒精灯和铁架台或三脚架外,①中所需的容器为_______;①和⑥中都用到的玻璃仪器为______________;
(2)已知试剂x为过氧化氢,写出H2O2与溶液B反应的离子方程式为________________;
(3)某同学取少量的溶液B向其中加入过量的某种强氧化剂,再滴加KSCN溶液,发现溶液变红色,放置一段时间后,溶液褪色,该同学猜测溶液褪色的原因是溶液中的SCN—被过量的氧化剂氧化所致。
现给出以下试剂:1.0 mol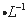 硫酸、1.0 mol
硫酸、1.0 mol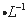 NaOH溶液、0.1 mol
NaOH溶液、0.1 mol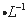 Fe2(SO4)3溶液、20%KSCN溶液、蒸馏水。请你设计合趣实验验证乙同学的猜测是否合理。简要说明实验步骤和现象_________________________________________________________。
Fe2(SO4)3溶液、20%KSCN溶液、蒸馏水。请你设计合趣实验验证乙同学的猜测是否合理。简要说明实验步骤和现象_________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
能源问题是人类社会面临的重大课题,H2、CO、CH3OH都是重要的能源物质,它们的燃烧热依次为-285.8 kJ·mol-1、-282.5 kJ·mol-1、-726.7 kJ·mol-1。已知CO和H2在一定条件下可以合成甲醇CO(g)+2H2(g)===CH3OH(l)。则CO与H2反应合成甲醇的热化学方程式为( )
A.CO(g)+2H2(g)===CH3OH(l) ΔH=-127.4 kJ·mol-1
B.CO(g)+2H2(g)===CH3OH(l) ΔH=127.4 kJ·mol-1
C.CO(g)+2H2(g)===CH3OH(g) ΔH=-127.4 kJ·mol-1
D.CO(g)+2H2(g)===CH3OH(g) ΔH=127.4 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
下列变化中,属于吸热过程的是( )
①液态水汽化 ②将胆矾加热变为白色粉末 ③浓硫酸稀释 ④氯酸钾分解制氧气
⑤生石灰跟水反应生成熟石灰
A.①④ B.②③ C.①④⑤ D.①②④
查看答案和解析>>
科目:高中化学 来源: 题型:
控制适合的条件,将反应2Fe3++2I-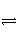
 2Fe2++I2设计成如下图所示的原电池。下列判断不正确的是( )
2Fe2++I2设计成如下图所示的原电池。下列判断不正确的是( )

A.反应开始时,乙中石墨电极上发生氧化反应
B.反应开始时,甲中石墨电极上的Fe3+被还原
C.电流计读数为零时,反应达到化学平衡状态
D.电流计读数为零后,在甲中溶入FeCl2固体,乙中的石墨电极为负极
查看答案和解析>>
科目:高中化学 来源: 题型:
据报道,在300 ℃、70 MPa下由二氧化碳和氢气合成乙醇已成为现实。
2CO2(g)+6H2(g) CH3CH2OH(g)+3H2O(g)
CH3CH2OH(g)+3H2O(g)
下列叙述错误的是( )
A.使用Cu-Zn-Fe催化剂可大大提高生产效率
B.反应需在300 ℃进行可推测该反应是吸热反应
C.充入大量CO2气体可提高H2的转化率
D.从平衡混合气体中分离出CH3CH2OH和H2O可提高CO2和H2的利用率
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com