
分析 在饱和硫酸铜溶液中加入少量无水的硫酸铜粉末时,硫酸铜粉末不再溶解,会以蓝色硫酸铜晶体的形式析出固体,带出溶液中的水,因此原溶液中的水减少了,因为原溶液是饱和溶液,水少了,就会析出硫酸铜,因此饱和溶液中溶质量减少,溶质、溶剂都少了,饱和溶液的总质量减少,但温度不变,最后得到的仍是硫酸铜饱和溶液.
解答 解:在饱和硫酸铜溶液中,加入少量无水硫酸铜粉末,过一段时间后,会析出硫酸铜晶体,得到该温度下的硫酸铜饱和溶液,溶液颜色不变,加入的无水硫酸铜会形成结晶水合物,质量变大,加入少量无水的硫酸铜粉末时,硫酸铜粉末不再溶解,会以蓝色硫酸铜晶体的形式析出固体,带出溶液中的水,因此原溶液中的水减少了,因为原溶液是饱和溶液,水少了,就会析出硫酸铜,因此饱和溶液中溶质量减少,溶质、溶剂都少了,饱和溶液的总质量减少,在饱和硫酸铜溶液中,加入少量无水硫酸铜粉末,过一段时间后,其颜色变蓝,质量变大,溶液质量变小,溶液浓度不变,
故答案为:变蓝;变大;变小;不变.
点评 本题考查了物质的结晶,是通过对实验方法和过程的探究,在比较鉴别的基础上,得出了正确的实验结论,是通过实验现象,从而得出正确的结论.题目难度中等.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:多选题
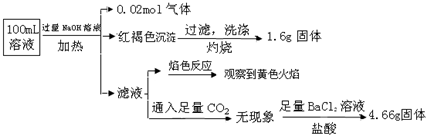
| A. | NH4+、Cl-、SO42-离子一定存在,CO32-离子一定不存在 | |
| B. | 原溶液中c(Fe3+)=0.4mol?L-1 | |
| C. | 溶液中至少有4种离子存在,其中Cl-一定存在,且c(Cl-)≥0.2mol•L-1 | |
| D. | 取少量原溶液于试管中,先加入适量氯水,再加少量KSCN溶液,若溶液成血红色,则含有Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
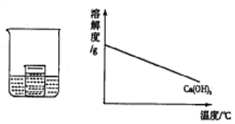 如图所示,在小烧杯中盛有饱和石灰水,大烧杯中盛有试剂X.将试剂Y加入到大烧杯X中,观察到小烧杯中的现象正确的是( )
如图所示,在小烧杯中盛有饱和石灰水,大烧杯中盛有试剂X.将试剂Y加入到大烧杯X中,观察到小烧杯中的现象正确的是( )| 序号 | 试剂X | 试剂Y | 小烧杯中的现象 |
| A | 水 | 硝酸铵 | 产生白色沉淀 |
| B | 水 | 浓硫酸 | 无明显变化 |
| C | 盐酸 | 镁条 | 产生白色沉淀 |
| D | 硫酸 | 氢氧化钠 | 无明显变化 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 100 | B. | $\frac{1}{100}$ | C. | 2 | D. | $\frac{1}{2}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:3:6 | B. | 2:3:9 | C. | 9:3:1 | D. | 1:2:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作及现象 | 实验结论 |
| A | 向某溶液中加入氯化钡溶液,有白色沉淀生成,再加盐酸酸化,沉淀不溶解 | 该溶液中一定含有SO42- |
| B | 向某溶液中加入NaOH溶液并加热,产生能使湿润的红色石蕊试纸变蓝的气体 | 原溶液中一定含有NH4+ |
| C | 向某溶液中加入稀盐酸,产生能使澄清石灰水变浑浊的无色无味气体 | 该溶液中一定含有CO32- |
| D | 用铂丝蘸取某溶液在无色火焰上灼烧直接观察火焰颜色未见紫色 | 原溶液中不含K+ |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
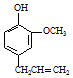 丁子香酚可用于配制康乃馨型香精及制作杀虫剂和防腐剂,结构简式如图.
丁子香酚可用于配制康乃馨型香精及制作杀虫剂和防腐剂,结构简式如图.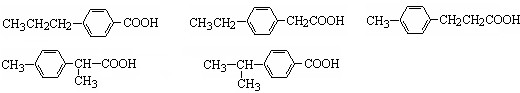 .
.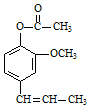 →A$→_{一定条件}^{CH_{3}CH_{2}Cl}$B(C12H16O2)→C(
→A$→_{一定条件}^{CH_{3}CH_{2}Cl}$B(C12H16O2)→C(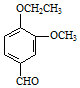 )
)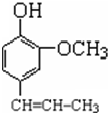 +CH3CH2Cl$\stackrel{一定条件}{→}$
+CH3CH2Cl$\stackrel{一定条件}{→}$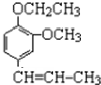 +HCl,反应类型为取代反应.C中滴加少量溴水振荡,主要现象为褪色.
+HCl,反应类型为取代反应.C中滴加少量溴水振荡,主要现象为褪色.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com