
| 滴定次数 | 待测液体积 (mL) | 标准盐酸体积(mL) | |
| 滴定前读数(mL) | 滴定后读数(mL) | ||
| 第一次 | 10.00 | 0.50 | 20.40 |
| 第二次 | 10.00 | 4.00 | 24.10 |
分析 (1)根据烧碱具有腐蚀性且容易潮解,选择称量时使用的仪器;
(2)根据操作步骤有称量、溶解、移液、洗涤、定容、摇匀等操作选择仪器来解答;
(3)根据碱性溶液盛放在碱式滴定管中;
(4)根据滴定过程中左右手及眼睛正确的操作方法解答;
(5)先判断数据的有效性,然后求出平均值,最后根据关系式HCl~NaOH来计算出氢氧化钠的浓度;再根据氢氧化钠溶液的浓度及体积计算出氢氧化钠的物质的量和质量,再计算出样品中氢氧化钠的纯度;
(6)根据c(待测)=$\frac{c(标准)×V(标准)}{V(待测)}$分析不当操作对V(标准)的影响,以此判断浓度的误差.
解答 解:(1)氢氧化钠容易潮解,具有很强的腐蚀性,称量时应该放在小烧杯中称量,所以称量使用的仪器有:托盘天平、药匙、烧杯;
故答案为:托盘天平、药匙、烧杯;
(2)操作步骤有称量、溶解、移液、洗涤、定容、摇匀等操作,将准确称取烧碱样品在烧杯中溶解,冷却后转移到250mL容量瓶中,并用玻璃棒引流,当加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,所以需要的仪器是:烧杯、玻璃棒、250mL容量瓶、胶头滴管;
故答案为:烧杯、玻璃棒、250mL容量瓶、胶头滴管;
(3)待测液是碱性溶液,用碱式滴定管量取;
故答案为:碱式滴定管;
(4)滴定过程中,左手旋转酸式滴定管的玻璃活塞,控制标准液的使用量;右手不停地摇动锥形瓶,使混合液反应充分,两眼注视锥形瓶中溶液颜色的变化,以便及时判断滴定终点,
故答案为:左;酸;右;锥形瓶中溶液颜色的变化;
(5)二次滴定消耗的标准液的体积分别为:19.90mL,20.10mL,两次滴定消耗的标准液的平均体积为20.00mL,
HCl~NaOH
1 1
0.20mol/L×20.00mL C(NaOH)×10.00mL;
解得:C(NaOH)=0.40mol/L,
250ml待测液中含有的氢氧化钠的物质的量为:0.40mol/L×0.25L=0.1mol,氢氧化钠的质量为:40g/mol×0.1mol=4.0g,样品中烧碱的纯度为:ω(NaOH)=$\frac{4.0g}{4.1g}$×100%=97.56%;
故答案为:97.56%;
(6)①碱式滴定管用蒸馏水洗净后没有用标准液润洗,标准液的浓度偏小,造成V(标准)偏大,根据c(待测)=$\frac{c(标准)×V(标准)}{V(待测)}$分析,可知c(待测)偏高,故①错误;
②酚酞指示剂变色时立即停止滴定,造成V(标准)偏小,根据c(待测)=$\frac{c(标准)×V(标准)}{V(待测)}$分析,可知c(待测)偏低,故②正确;
③锥形瓶用蒸馏水洗净后没有用待测液润洗,消耗标准液的体积不变,根据c(待测)=$\frac{c(标准)×V(标准)}{V(待测)}$分析,可知c(待测)无影响,故③错误;
④滴定前滴定管尖端有气泡,滴定后气泡消失,造成V(标准)偏大,根据c(待测)=$\frac{c(标准)×V(标准)}{V(待测)}$分析,可知c(待测)偏高,故④错误;
⑤终点读数时俯视,其他读数方法正确,造成V(标准)偏小,根据c(待测)=$\frac{c(标准)×V(标准)}{V(待测)}$分析,可知c(待测)偏低,故⑤正确;
故选②⑤.
点评 本题主要考查了酸碱中和滴定的操作、误差分析,化学计算,难度中等,掌握中和滴定的原理、步骤是解题的关键.


 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案科目:高中化学 来源: 题型:选择题
| A. | 电离度α为10% | B. | α=20% | ||
| C. | pH=1 | D. | c(OH-)=1×10-12mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 增大压强,活化分子百分数增大,化学反应速率一定增大 | |
| B. | 升高温度,活化分子百分数增大,化学反应速率一定增大 | |
| C. | 加入反应物,活化分子百分数增大,化学反应速率增大 | |
| D. | 使用催化剂,降低了反应的活化能,增大了活化分子百分数,化学反应速率一定增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
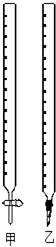 用0.1320mol/L的HCl溶液滴定未知浓度的NaOH溶液,实验数据如表所示,
用0.1320mol/L的HCl溶液滴定未知浓度的NaOH溶液,实验数据如表所示,| 实验编号 | 待测NaOH溶液的体积/mL | HCl溶液的体积/mL |
| 1 | 25.00 | 24.41 |
| 2 | 25.00 | 24.39 |
| 3 | 25.00 | 24.60 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

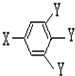 (其中:-X、-Y均为官能团)
(其中:-X、-Y均为官能团)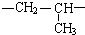
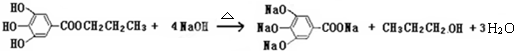
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com