


科目:高中化学 来源: 题型:
| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 一定条件 |
| A、2 min时,c(SO2)=0.6 mol?L-1 |
| B、用O2表示4 min内的反应速率为0.1 mol?(L?min)-1 |
| C、再向容器中充入1 mol SO3,达到新平衡,n(SO2):n(O2)=2:1 |
| D、4 min后,若升高温度,平衡向逆方向移动,平衡常数K减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| AgCl | AgI | Ag2S | |
| Ksp | 1.8×10-10 | 8.51×10-16 | 6.3×10-50 |
| A、沉淀转化的实质就是沉淀溶解平衡的移动 |
| B、溶解度小的沉淀可以转化为溶解度更小的沉淀 |
| C、AgCl固体在等物质的量浓度的NaCl、CaCl2溶液中的溶解程度相同 |
| D、25℃时,在饱和AgCl、AgI、Ag2S溶液中,所含Ag+的浓度不同 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 催化剂 |
| △ |
| A、0.24 mol?L-1 |
| B、0.28 mol?L-1 |
| C、0.32 mol?L-1 |
| D、0.26 mol?L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
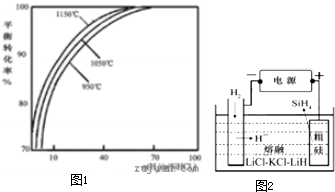 多晶硅是太阳能光伏产业的重要原料.
多晶硅是太阳能光伏产业的重要原料.查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
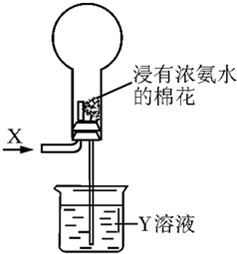
| A、若X为HCl,则烧瓶内可产生白雾 |
| B、选择适当的X和Y溶液可产生有色喷泉 |
| C、若烧瓶内产生喷泉,则Y溶液一定呈酸性 |
| D、若通入气体为Cl2,则烧瓶内一定无喷泉产生 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Mg、Ag |
| B、Fe、Mg |
| C、Al、Cu |
| D、Mg、Al |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com