
| A. | 在反应KClO3+6HCl=KCl+3Cl2↑+3H2O中,当得到标准状况下67.2 L Cl2时,反应中转移的电子数为6 NA | |
| B. | 6.0 g SiO2晶体中含有的硅氧键数目为0.2 NA | |
| C. | 标准状况下,22.4 L NO和11.2 L O2混合后气体的分子总数为NA | |
| D. | S2和S8的混合物共6.4 g,其中所含硫原子数一定为0.2 NA |
分析 A、反应KClO3+6HCl=KCl+3Cl2↑+3H2O生成3mol氯气转移5mol电子;
B、求出二氧化硅的物质的量,然后根据二氧化硅中含4条硅氧键来分析;
C、NO和氧气反应后生成的NO2中存在平衡:2NO2?N2O4;
D、S2和S8均由硫原子构成.
解答 解:A、反应KClO3+6HCl=KCl+3Cl2↑+3H2O生成3mol氯气转移5mol电子,故当生成标况下67.2L氯气即3mol氯气时,转移3NA个电子,故A错误;
B、6.0g二氧化硅的物质的量为0.1mol,而二氧化硅中含4条硅氧键,故0.1mol二氧化硅中含0.4NA条硅氧键,故B错误;
C、NO和氧气反应后生成的NO2中存在平衡:2NO2?N2O4,导致分子个数减少,故最终分子个数小于NA个,故C错误;
D、S2和S8均由硫原子构成,故6.4g混合物中含有的硫原子的物质的量为0.2mol,个数为0.2NA个,故D正确.
故选D.
点评 本题考查了阿伏伽德罗常数的有关计算,难度不大,应注意掌握公式的运用和物质的结构.


 新思维假期作业暑假吉林大学出版社系列答案
新思维假期作业暑假吉林大学出版社系列答案 蓝天教育暑假优化学习系列答案
蓝天教育暑假优化学习系列答案科目:高中化学 来源: 题型:选择题
| A. | CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-890 kJ/mol | |
| B. | $\frac{1}{2}$CH4(g)+O2(g)═$\frac{1}{2}$CO2(g)+H2O(l)△H=-445 kJ/mol | |
| C. | $\frac{1}{2}$CO2(g)+H2O(l)═$\frac{1}{2}$CH4(g)+O2(g)△H=+445 kJ/mol | |
| D. | CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-55.625 kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 吸氧腐蚀时正极放出O2 | |
| B. | 析氢腐蚀时正极放出H2 | |
| C. | 析氢腐蚀比吸氧腐蚀普遍 | |
| D. | 析氢腐蚀与吸氧腐蚀的负极反应都是Fe-3e-=Fe3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
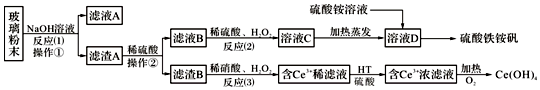
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ⅥA族的氧、硫、硒(Se)、碲(Te)等元素在化合物中常表现出多种化合价,含ⅥA族元素的化合物在研究和生产中有许多重要用途.请回答下列问题:
ⅥA族的氧、硫、硒(Se)、碲(Te)等元素在化合物中常表现出多种化合价,含ⅥA族元素的化合物在研究和生产中有许多重要用途.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
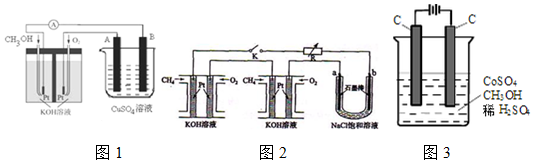
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com