
 氮氧化物是造成雾霾天气的主要原因之一,消除氮氧化物有多种方法.
氮氧化物是造成雾霾天气的主要原因之一,消除氮氧化物有多种方法.分析 (1)①△H<0,反应为放热反应,反应物总能量大于生成物总能量;
②氧化还原反应中,化合价升高的数值=化合价降低数值=转移电子数;
③元素化合价升高失电子发生氧化反应的物质做还原剂,结合化学方程式定量关系计算氧化产物与还原产物的质量比;
(2)①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)△H=-574kJ/mol
②CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g)△H=-867kJ/mol
依据盖斯定律计算②×2-①得到所需热化学方程式;
(3)根据信息知道一氧化氮和二氧化氯之间反应生成产物是硝酸、盐酸以及二氧化氮,根据化学方程式结合电子守恒来计算;
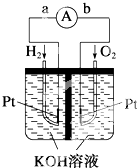
(4)(1)原电池是将化学能转变为电能的装置,原电池放电时,电子从负极沿导线流向正极;
(2)负极上燃料失电子发生还原反应,正极上氧气得电子生成氢氧根离子;
(3)参加反应的物质浓度增大,反应速率加快.
解答 解:(1)①化学反应可表示为:2NH3(g)+NO(g)+NO2(g)═2N2(g)+3H2O(g)△H<0,故焓变小于0说明反应为放热反应,反应物总能量大于生成物总能量,
故答案为:>;
②根据化合价升高的数值=化合价降低数值=转移电子数,化合价升高情况:2NH3~6e-~N2,所以当有2mol N2(g)生成,该反应的电子转移的量是6mol,
故答案为:6;
③反应中氨气中氮元素化合价-3价升高为0价,失电子做还原剂被氧化得到氧化产物N2,2NH3(g)被氧化得到1mol氧化产物N2,所以还原产物氮气物质的量为1mol,氧化产物与还原产物的质量比为1:1,
故答案为:NH3; 1:1;
(2)①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)△H=-574kJ/mol
②CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g)△H=-867kJ/mol
依据盖斯定律计算②×2-①得到CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)△H=-1160kJ•mol-1,
故答案为:CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)△H=-1160kJ•mol-1;
(3)根据信息知道一氧化氮和二氧化氯之间反应生成产物是硝酸、盐酸以及二氧化氮,反应方程式为:2NO+ClO2+H2O=NO2+HNO3+HCl,根据物质的性质及化合价变化可知:2NO~5e-~NO2+HNO3,ClO2~5e-~HCl,所以有2NO2~ClO2.根据物质的性质及化合价变化可知:2NO2~8e-~N2,Na2SO3~2e-~Na2SO4,所以有2NO2~4 Na2SO3.根据关系式有:2ClO2~2NO2~N2,反应中若生成22.4L N2(标准状况),物质的量为1mol,则n(ClO2)=2n(NO2)=2 mol,m(ClO2)=2mol×67.5g/mol=135g,
故答案为:2NO+ClO2+H2O=NO2+HNO3+HCl; 135;
(4)(1)该装置是把化学物质中的能力转化为电能,所以是化学能转变为电能;在原电池中,负极上失电子,正极上得电子,电子的流向是从负极流向正极,所以是 由a到b,电流方向为b→a,
故答案为:化学能转变为电能;b→a;
(2)碱性环境中,该反应中负极上氢气失电子生成氢离子,电极反应式为H2+2OH--2e-═2H2O,正极上氧气得电子生成氢氧根离子,电极反应式为2H2O+O2+4e-═4OH-,故答案为:H2-2e-+2OH-=2H2O;
(3)电极表面镀铂粉,增大了电极单位面积吸附H2、O2的分子数,使反应物的浓度增大,反应速率加快,
故答案为:增大电极单位面积吸附H2、O2的分子数,加快电极反应速率.
点评 本题涉及氧化还原反应中的概念、盖斯定律的应用、化学平衡的有关计算、化学电源的工作原理等综合知识,注意知识的迁移和应用是关键,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ①②④ | C. | ①②③ | D. | 全部 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
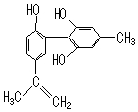
| A. | 该有机物分子式为C16H16O3 | |
| B. | 1 mol该物质与浓溴水反应时,最多消耗3 molBr2 | |
| C. | 该分子中的氢原子不可能都在同一个平面上 | |
| D. | 滴入酸性高锰酸钾溶液,紫色褪去,不能证明结构中存在碳碳双键 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
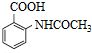 的合成路线流程图(无机试剂任用).合成路线流程图示例:CH2CH2$\stackrel{Br_{2}}{→}$CH2BrCH2Br$→_{△}^{NaOH水溶液}$CH2OHCH2OH
的合成路线流程图(无机试剂任用).合成路线流程图示例:CH2CH2$\stackrel{Br_{2}}{→}$CH2BrCH2Br$→_{△}^{NaOH水溶液}$CH2OHCH2OH查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X的分子式为C5H10O2 | |
| B. | X可能的结构有两种 | |
| C. | Y中含有的官能团有羧基和碳碳双键 | |
| D. | X与Y相对分子质量相差14,则X与Y互为同系物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 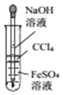 用所示装置制取并观察Fe(OH)2 | |
| B. | 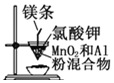 用所示装置制取金属锰 | |
| C. | 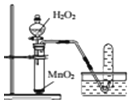 用所示装置制取干燥的O2 | |
| D. | 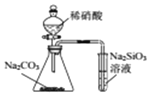 用所示装置比较N、C、Si的非金属性强弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
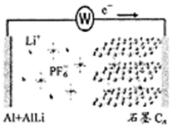 中科院深圳研究院成功开发出一种新型铝-石墨双离子电池,可大幅度提升电动汽车的使用性能,其工作原理如图所示.充电过程中,石墨电极发生阴离于插层反应,而铝电极发生铝-锂合金化反应,下列叙述正确的是( )
中科院深圳研究院成功开发出一种新型铝-石墨双离子电池,可大幅度提升电动汽车的使用性能,其工作原理如图所示.充电过程中,石墨电极发生阴离于插层反应,而铝电极发生铝-锂合金化反应,下列叙述正确的是( )| A. | 放电时,电解质中的Li+向左端电极移动 | |
| B. | 充电时,与外加电源负极相连一端电极反应为:AlLi-e-═Li++Al | |
| C. | 充电时,若转移0.2 mol电子,则铝电极上增重5.4 g | |
| D. | 放电时,正极反应式为CR(PF6)+e-═PF6-+CR |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 从左到右,金属性减弱 | B. | 从左到右,非金属性增强 | ||
| C. | 从左到右,正化合价的数值增大 | D. | 从左到右,原子半径逐渐增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
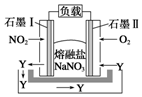 燃煤废气中的氮氧化物(NOx)、二氧化碳等气体,常用下列方法处理,以实现节能减排、废物利用等.
燃煤废气中的氮氧化物(NOx)、二氧化碳等气体,常用下列方法处理,以实现节能减排、废物利用等.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com