
| 实验序号 | A | B | C | D | E |
| 硝酸溶液体积 | 100ml | 200mL | 300mL | 400mL | 500mL |
| 剩余固体的质量 | 17.2g | 8g | 0g | 0g | 0g |
| 气体体积 | 2.24L | 4.48L | 6.72L | 7.84L | 7.84L |
分析 (1)由A、B两组数据分析,两次剩余物的质量相差9.2g,此时生成2.24 LNO气体,转移0.15 mol电子,若只溶解铁,质量为8.4 g,若只溶解铜,质量为9.6 g,由此可知这9.2 g中应有Fe和Cu两种金属,所以A组实验后剩余金属为Fe和Cu,B组实验后剩余金属只有Cu;
(2)假设在实验A的基础上再加入100mL硝酸溶液溶解的9.2g金属中Fe、Cu物质的量分别为xmol、ymol,根据二者质量及转移电子守恒列方程计算,混合物中Cu的质量为剩余金属(Cu)的质量与反应Cu的质量之和,再结合实验D及电子守恒计算出每份混合物中含有铁的物质的量;
(3)根据C组中属于金属为0可知铜完全反应,则铜完全转化成铜离子;再根据电子守恒计算出C中含有的亚铁离子、铁离子的物质的量,最后计算出其物质的量之比.
解答 解:(1)由A、B两组数据分析,两次剩余物的质量相差为:17.2g-8g=9.2g,此时生成2.24 LNO气体,NO的物质的量为:$\frac{2.24L}{22.4L/mol}$=0.1mol,转移电子为:0.1mol×(5-2)=0.3 mol电子,若只溶解铁,根据电子守恒,溶解铁的质量为:56g/mol×$\frac{0.3mol}{2}$=8.4 g;若只溶解铜,质量为:64g/mol×$\frac{0.3mol}{2}$=9.6 g,由此可知溶解的9.2 g金属为Fe和Cu的混合物,所以A组实验后剩余金属为Fe和Cu,B组实验后剩余金属只有Cu,
故答案为:Fe、Cu;Cu;
(2)设在实验A的基础上再加入100mL硝酸溶液溶解的9.2g金属中Fe、Cu物质的量分别为xmol、ymol,则:
由质量可得:56x+64 y=9.2
根据电子转移守恒可得:2(x+y)=3×0.1,
解得:x=0.05、y=0.1,
故混合物中Cu的物质的量为0.1mol,则每次所取混合物中铜物质的量为:0.1mol+$\frac{8g}{64g/mol}$=0.225mol,
根据实验D和E可知,最终生成NO的体积为7.84L,物质的量为:$\frac{7.84L}{22.4L/mol}$=0.35mol,得到电子总物质的量为:0.35mol×3=1.05mol,
0.225mol铜完全反应失去0.45mol电子,由于硝酸足量实验D中铁完全变成铁离子,根据电子守恒,混合物中含有Fe的物质的量为:$\frac{1.05mol-0.45mol}{3}$=0.20mol,
所以实验中每次所取混合物中铁的物质的量为0.20mol,
故答案为:0.20.
(3)根据(2)的计算可知,每份混合金属中含有0.2molFe、0.225molCu,由于C中金属完全反应,则0.225mol铜完全反应生成0.225molCu2+;
根据实验D中仍然生成NO气体可知C中一定含有Fe2+,设C中含有Fe2+、Fe3+的物质的量分别为x、y,根据铁元素的物质的量可得:x+y=0.20,根据电子守恒可知:2x+3y+0.225×2=$\frac{6.72L}{22.4L/mol}$×3,联立解得:x=0.15mol、y=0.05mol,
所以实验C中含有的Fe2+、Cu2+、Fe3+的物质的量之比为:n(Fe2+):n(Cu2+):n(Fe3+)=0.15mol:0.225mol:0.05mol=6:9:2,
故答案为:Fe2+、Cu2+、Fe3+;n(Fe2+):n(Cu2+):n(Fe3+)=6:9:2.
点评 本题考查混合物计算、硝酸性质,题目难度中等,明确发生的反应判断反应进行程度是解题关键,(1)中注意利用极限法进行解答,试题培养了学生的分析能力及化学计算能力.


科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 镁在空气中燃烧发出耀眼的白光,可用于制作照明弹 | |
| B. | 在一定条件下可实现下列转化MgCl2(溶液)→Mg(OH)2→MgO | |
| C. | 通过置换反应可实现由Mg到MgO的转化 | |
| D. | 镁与稀硝酸反应的离子方程式为:Mg+2H+═Mg+H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 以天然气为原料合成甲醇常见的方法有水煤气法和目前正在开发的直接氧化法.
以天然气为原料合成甲醇常见的方法有水煤气法和目前正在开发的直接氧化法.查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在水电离出的c(H+)=1×10-13mol/L的溶液中下列离子一定能大量共存:Na+、CO32-、Cl-、K+ | |
| B. | 氢氧根离子浓度相同的氢氧化钠溶液和氨水导电能力相同 | |
| C. | K2SO3溶液中c(K+)与c(SO32-)之比为2:1 | |
| D. | 硫酸是强电解质,故纯硫酸能导电 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | σ键是由两个p电子“肩并肩”重叠形成的 | |
| B. | σ键和π键都是共价键,σ键比π键更稳定 | |
| C. | 乙烯分子中的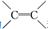 和乙炔分子中的-C≡C-都是π键 和乙炔分子中的-C≡C-都是π键 | |
| D. | H2分子中含有σ键,HCl分子中含π键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③⑤⑦⑨ | B. | ②④⑧⑩ | C. | ①③ | D. | 全部 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)/mol | 0.20 | 0.10 | 0.08 | 0.07 | 0.07 | 0.07 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com