
下列现象与氢键有关的是( )
①NH3的熔沸点比第ⅤA族相邻元素的氢化物高
②NH3易溶于水
③冰的密度比液态水的密度小
④尿素的熔沸点比醋酸的高
⑤邻羟基苯甲酸的熔沸点比对羟基苯甲酸的低
⑥水分子高温下也很稳定
A.①②③④⑤⑥ B.①②③④⑤
C.①②③④ D.①②③
 课课练江苏系列答案
课课练江苏系列答案 名牌中学课时作业系列答案
名牌中学课时作业系列答案 明天教育课时特训系列答案
明天教育课时特训系列答案科目:高中化学 来源: 题型:
钠硫电池以熔融金属钠、熔融硫和多硫化钠(Na2Sx)分别作为两个电极的反应物,固体Al2O3陶瓷(可传导Na+)为电解质,充电时,总反应为Na2Sx === 2Na + xS(3<x<5),其反应原理如图所示,下列说法错误的是( )
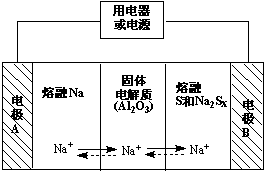
A.放电时,电极A为负极
B.该电池工作的适宜温度应控制10℃左右
C.放电时,内电路中Na+的移动方向为A到B
D.充电时,阳极的电极反应式为 Sx2- - 2e- === xS
查看答案和解析>>
科目:高中化学 来源: 题型:
碘被称为“智力元素”,科学合理地补充碘可防止碘缺乏病。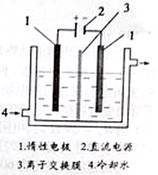 碘酸钾(KIO3)是国家规定的食盐加碘剂,它的晶体为白色,可溶于水。碘酸钾在酸性介质中与过氧化氢或碘化物作用均生成单质碘。以碘为原料,通过电解制备碘酸钾的实验装置如右图所示。
碘酸钾(KIO3)是国家规定的食盐加碘剂,它的晶体为白色,可溶于水。碘酸钾在酸性介质中与过氧化氢或碘化物作用均生成单质碘。以碘为原料,通过电解制备碘酸钾的实验装置如右图所示。
请回答下列问题:
(1)碘是 (填颜色)固体物质,实验室常用 方法来分离提纯含有少量杂质的固体碘。
(2)写出碘酸钾在酸性介质中与过氧化氢反应的离子方程式:
(3)电解前,先将一定量的精制碘溶于过量氢氧化钾溶液,溶解时发生反应:3I2+6KOH=5KI+KIO3+3H2O,将该溶液加入阳极区。另将氢氧化钾溶液加入阴极区,电解槽用水冷却。图中的序号3应为 离子交换膜(填“阳”或“阴”);电解时,阳极上发生反应的电极反应式为 。
(4)教材中利用KI与空气的反应来探究反应速率与温度的关系,现有1mol/L的KI溶液、0.1mol/L的H2SO4溶液、淀粉溶液,则实验时这几种试剂的加入顺序为:
KI溶液、 、 ;反应的离子方程式为 。
(5)已知KI+I2 KI3,将I2溶于KI溶液,在低温条件下,可制得KI3·H2O。该物质作为食盐加碘剂是否合适?______(填“是”或“否”),并说明理由_______________________________。为了提高加碘盐(添加KI)的稳定性,可加稳定剂减少碘的损失。下列物质中有可能作为稳定剂的是___________________。
KI3,将I2溶于KI溶液,在低温条件下,可制得KI3·H2O。该物质作为食盐加碘剂是否合适?______(填“是”或“否”),并说明理由_______________________________。为了提高加碘盐(添加KI)的稳定性,可加稳定剂减少碘的损失。下列物质中有可能作为稳定剂的是___________________。
A.Na2S2O3 B.AlCl3 C.Na2CO3 D.NaNO2
查看答案和解析>>
科目:高中化学 来源: 题型:
元素的性质呈现周期性变化的根本原因是( )
A.原子半径呈周期性变化
B.元素的化合价呈周期性变化
C.元素原子的核外电子排布呈周期性变化
D.第一电离能呈周期性变化
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组物质的晶体中,化学键类型相同,晶体类型也相同的是( )
A.SO2和SiO2 B.CO2和H2O
C.NaCl和HCl D.CCl4和KCl
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)以下列出的是一些原子的2p能级和3d能级中电子排布的情况。试判断,违反了泡利原理的是 , 违反了洪特规则的是 。
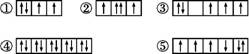
(2)某元素的激发态(不稳定状态)原子的电子排布式为1s22s22p63s13p33d2,则该元素基态原子的电子
排布式为 ;其最高价氧化物对应水化物的化学式是 。
(3)用符号“>”“<”或“=”表示下列各项关系。
①第一电离能:Na Mg, Mg Ca。
②电负性:O F, F Cl。
③能量高低:ns (n+1)s, ns np。
④主族序数 价电子数 元素最高正化合价。
查看答案和解析>>
科目:高中化学 来源: 题型:
用如图装置电解硫酸钾溶液制取氢气,氧气,硫酸和氢氧化钾。从开始通电时,收集B和C逸出的气体。1 min后测得B口的气体体积为C口处的一半,下列说法不正确的是( )
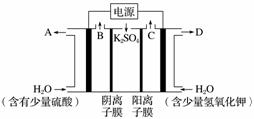
A.电源左侧为正极
B.电解槽左侧的电极反应方程式为2H2O-4e-===O2+4H+
C.D口导出的溶液为KOH溶液,且浓度比刚加入电解槽右侧时的浓度大
D.在标准状况下,若1 min后从C口处收集到的气体比B口处收集到的气体多2.24 L,则有0.1NA个SO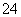 通过阴离子膜
通过阴离子膜
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com