
【题目】下列离子方程式的书写及评价均合理的是( )
选项 | 离子方程式 | 评价 |
A | 将1 mol Cl2通入到含1 mol FeI2溶液中: 2Fe2++2I-+2Cl2==2Fe3++4Cl-+I2 | 正确;Cl2过量,可将Fe2+、I-均氧化 |
B | Mg(HCO3)2溶液与足量的NaOH溶液反应: Mg2++HCO | 正确;酸式盐与碱反应生成正盐和水 |
C | 过量SO2通入到NaClO溶液中: SO2+H2O+ClO-==HClO+HSO | 正确;说明酸性: H2SO3强于HClO |
D | 1 mol·L-1的NaAlO2溶液和2.5 mol·L-1的HCl溶液等体积互相均匀混合:2AlO | 正确;AlO |
【答案】D
【解析】
试题分析:A、将1mol Cl2通入到含1mol FeI2的溶液中,只能够将碘离子氧化完全,正确的离子方程式为Cl2+2I-=2Cl-+I2,正确的评价为Cl2不足,只氧化I-,故A错误;B、Mg(HCO3)2溶液与足量的NaOH溶液反应,正确的离子方程式为Mg2++2HCO3-+4OH-=Mg(OH)2↓+2H2O+2CO32-,故B错误;C、过量SO2通入到NaClO溶液中,SO32-有强还原性,ClO-有强氧化性,发生氧化还原反应,正确的离子方程式为SO2+H2O+ClO-=2H++SO42-+Cl-,故C错误;D、1mol/L的NaAl(OH)4溶液和2.5mol/L的HCl溶液等体积互相均匀混合反应方程式为:2[Al(OH)4]-+5H+=Al3++Al(OH)3↓+5H2O,如果盐酸过量继续和Al(OH)3反应,所以1mol[Al(OH)4]-和盐酸反应最多消耗4molH+,[Al(OH)4]-与Al(OH)3消耗的H+的物质的量之比在(1~4):3,故D正确;故选D。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】O2和O3是氧元素的两种单质,根据其分子式完成下列各题:
(1)等质量的O2和O3所含分子个数比为________,原子个数比为_________,分子的物质的量之比为_________。
(2)等温等压下,等体积的O2和O3(均为气态)所含分子个数比为___________,原子个数比为___________,质量比为___________。
(3)设NA为阿伏加德罗常数的数值,如果a g氧气中含有的分子数为b,则c g氧气在标准状况下的体积约是___________(用含NA的式子表示)。
(4)配制100 mL 1 mol/L的稀H2SO4溶液,需要用量筒量取浓H2SO4(密度为1.84 g·mL-1,质量分数为98%)的体积为___________mL。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】生物大分子在生物体的生命活动中具有重要的作用。碳原子本身的化学性质,使它能够通过化学键连接成链或环,从而形成各种生物大分子。可以说,地球上的生命是在碳元素的基础上建立起来的。以上事实说明( )
A. C元素能组成所有的化合物
B. C元素是构成细胞的最基本的元素
C. C元素是各种大分子中含量最多的元素
D. C元素比其他元素重要
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从海水中可提取各种化工产品,下图是工业上对海水的一种综合利用的流程图:
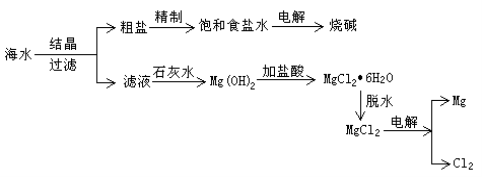
⑴ 在实验室对海水进行过滤,所需要玻璃仪器为烧杯、漏斗和 ,补填的玻璃仪器在过滤时,起到了 的作用。
⑵ 若粗盐中仅含有Ca2+、Mg2+两种杂质离子。精制提纯时,备用的除杂试剂有:(A.盐酸 B.Na2CO3溶液 C.NaOH溶液)请你正确排列加入的顺序:( )、( )、( )(填编号)
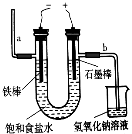
⑶ 用如图电解食盐水,石墨电极上产生的气体为 ;在铁棒周围的溶液里滴加酚酞,溶液变 色。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】紫菜与海带类似,是一种富含生物碘的海洋植物。商品紫菜轻薄松脆、比海带更易被焙烧成灰实验室里从紫菜中提取碘的流程如下图:
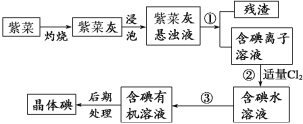
(1)实验室焙烧紫菜,需要下列仪器中的___________(填序号)。
a.试管 b.烧杯 c.坩埚 d.泥三角 e.铁三脚架 f.酒精灯
(2)指出提取碘的过程中有关的实验操作名称:①____________,③______________。
(3)提取碘的过程中,可选择的有机试剂是( )
A.酒精 B.苯 C.乙酸 D.食盐水
选择该试剂的理由是_________________________。
(4)为使紫菜灰中碘离子转化为碘的有机溶液,实验室有烧杯、玻璃棒、集气瓶、酒精灯、导管、圆底烧瓶、石棉网以及必要的夹持仪器、物品,尚缺少的玻璃仪器有______________、________________。
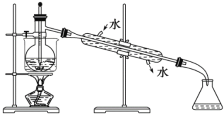
(5)从含碘的有机溶液中提取碘和回收有机溶剂,还须经过蒸馏,观察上面实验装置图改正其中的错误之处:
①_____________________________;
②_____________________________;
③_____________________________。
(6)进行上述蒸馏操作时,使用水浴加热,最后晶态碘在 里聚集。
查看答案和解析>>
科目:高中化学 来源: 题型:
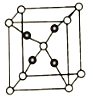
【题目】[化学—选修3:物质结构与性质]
A、B、C、D、E为原子序数依次增大的前四周期的元素,A的核外电子总数与其周期数相同。B是同周期元素未成对电子数最多的元素,C的最外层电子数为其电子层数的3倍,B与D同族;回答下列问题:
(1).D的一种单质,难溶于水,较易溶于苯且易自燃,其立体结构为_______________,D原子的杂化类型为_______________。
(2).A和B的单质反应可生成化合物M,常温下M为气态,易液化可作制冷剂。A和D的单质反应得到化合物N,M的沸点________(填“大于”、“小于”、或“等于”)N的沸点,原因是_______________。
(3).已知N可以与E的一种盐溶液反应,生成红色固体单质和两种高沸点酸。E原子的外围电子排布图为____________________。写出相应的化学反应方程式:____________________。
(4).将M通入E的硫酸盐溶液中,可得到深蓝色透明溶液,再向溶液中加入一定量的乙醇,有深蓝色晶体析出。写出离子反应方程式:__________________,加入乙醇的作用是________________。
(5).E和C能形成化合物G,其晶体结构如图25所示,G的化学式为__________。若两个氧原子间最短距离为apm,列式计算晶体G的密度_______g.cm-3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子反应方程式正确的是()
A.向AlCl3溶液中加入过量氨水:Al3++4NH3·H2O=4NH4++AlO2-+2H2O
B.向NaHCO3溶液中加入过量的澄清石灰水,出现白色沉淀:
2HCO3-+Ca2++2OH-=CaCO3↓+CO32-+2H2O
C.NO2与水的反应:3NO2+H2O=2HNO3+NO
D.工业冶炼金属钠:2NaCl![]() 2Na+Cl2↑
2Na+Cl2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】同温同压下,甲容器中充满35Cl2,乙容器中充满37Cl2,下列叙述不正确的是( )
A.若两种气体体积相等,甲、乙两容器中气体的密度之比为35∶37
B.若两种气体体积相等,甲、乙两容器中气体分子数之比为35∶37
C.若两种气体质量相等,甲、乙两容器中气体所含质子数之比为37∶35
D.若两种气体体积相等,甲、乙两容器中气体所含中子数之比为9∶10
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.催化剂不影响反应活化能,但能增大单位体积内活化分子百分数,从而增大反应速率
B.化学反应速率为0.8 mol/(L·s)是指1 s时某物质的浓度为0.8 mol/L
C.根据化学反应速率的大小可以判断化学反应进行的快慢
D.对于化学反应来说,反应速率越大,反应现象越明显
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com