
目前流行的关于生命起源假设的理论认为,生命起源于约40亿年前的古洋底的热液环境,这种环境系统中普遍存在铁硫簇结构,如Fe2S2、Fe4S4、Fe8S7等,这些铁硫簇结构参与了生命起源的相关反应。某化学兴趣小组在研究某铁硫簇结构的组成时,设计了下列实验。
【实验Ⅰ】 确定硫的质量:
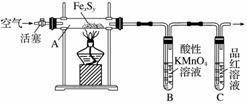
按图连接装置,检查好装置的气密性后,在硬质玻璃管A中放入1.0 g铁硫簇结构(含有部分不反应的杂质),在试管 B中加入50 mL 0.100 mol·L-1的酸性KMnO4溶液,在试管C中加入品红溶液。通入空气并加热,发现固体逐渐转变为红棕色。待固体完全转化后,将B中溶液转移至 250 mL 容量瓶,洗涤试管B后定容。取25.00 mL 该溶液用0.01 mol·L-1的草酸(H2C2O4)溶液滴定剩余的 KMnO4。记录数据如下:
| 滴定次数 | 待测溶液体积/mL | 草酸溶液体积/mL | |
| 滴定前刻度 | 滴定后刻度 | ||
| 1 | 25.00 | 1.50 | 23.70 |
| 2 | 25.00 | 1.02 | 26.03 |
| 3 | 25.00 | 0.00 | 24.99 |
相关反应:①2MnO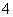 +2H2O+5SO2===2Mn2++5SO
+2H2O+5SO2===2Mn2++5SO +4H+
+4H+
②2MnO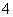 +6H++5H2C2O4===2Mn2++10CO2↑+8H2O
+6H++5H2C2O4===2Mn2++10CO2↑+8H2O
【实验Ⅱ】 确定铁的质量:
将实验Ⅰ硬质玻璃管A中的残留固体加入稀盐酸中,充分搅拌后过滤,在滤液中加入足量的NaOH溶液,过滤后取滤渣,经充分灼烧得0.6 g固体。
试回答下列问题:
(1)判断滴定终点的方法是______________________________________________
________________________________________________________________________。
(2)试管C中品红溶液的作用是_____________________________________________。
有同学提出,撤去C装置对实验没有影响,你的看法是________(选填“同意”或“不同意”),理由是___________________________________________________
________________________________________________________________________。
(3)根据实验Ⅰ和实验Ⅱ中的数据可确定该铁硫簇结构的化学式为________________________________________________________________________。
【问题探究】 滴定过程中,细心的同学发现该KMnO4溶液颜色褪去的速率较平常滴定时要快得多。为研究速率加快的原因,该同学继续进行了下列实验,实验数据如下表:
| 编号 | 温度/℃ | 酸化的H2C2O4溶液/mL | KMnO4溶液/mL | 溶液褪色时间/s |
| 1 | 25 | 5.0 | 2.0 | 40 |
| 2 | 25 | 5.0(另加少量可溶于水的MnSO4粉末) | 2.0 | 4 |
| 3 | 60 | 5.0 | 2.0 | 25 |
(4)分析上述数据,滴定过程中反应速率加快的一种可能原因是___________________
________________________________________________________________________。
答案 (1)当滴入最后一滴草酸溶液时,锥形瓶中溶液由浅红色变为无色,且半分钟内不变化
(2)验证SO2是否被酸性KMnO4溶液完全吸收 同意
当B中溶液颜色不变化,即可证明SO2已被酸性KMnO4溶液完全吸收
(3)Fe3S4
(4)Mn2+对反应起到催化作用(或反应放热使温度升高),加快反应速率
解析 (3)第1次滴定时H2C2O4溶液体积误差较大,舍去,第2、3次取平均值,V(H2C2O4)=25.00 mL。与H2C2O4反应的KMnO4的物质的量为0.01 mol·L-1×0.025 L×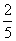 =0.000 1 mol,与SO2反应的KMnO4的物质的量为 0.05 L×0.100 mol·L-1-10×0.000 1 mol=0.004 mol,n(SO2)=0.004 mol×
=0.000 1 mol,与SO2反应的KMnO4的物质的量为 0.05 L×0.100 mol·L-1-10×0.000 1 mol=0.004 mol,n(SO2)=0.004 mol× =0.01 mol,n(S)=0.01 mol;0.6 g 固体为Fe2O3,n(Fe)=
=0.01 mol,n(S)=0.01 mol;0.6 g 固体为Fe2O3,n(Fe)=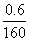 ×2 mol=0.007 5 mol,
×2 mol=0.007 5 mol,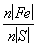 =
= =
= ,所以该铁硫簇结构的化学式为Fe3S4。(4)对比实验1、2知,Mn2+可使反应速率加快;对比实验1、3知,温度升高,反应速率加快。
,所以该铁硫簇结构的化学式为Fe3S4。(4)对比实验1、2知,Mn2+可使反应速率加快;对比实验1、3知,温度升高,反应速率加快。


 全能练考卷系列答案
全能练考卷系列答案 一课一练课时达标系列答案
一课一练课时达标系列答案科目:高中化学 来源: 题型:
足量铜与一定量浓硝酸反应,得到硝酸铜溶液和NO2、N2O4、NO的混合气体,将这些气体与1.68 L O2(标准状况)混合后通入水中,所有气体完全被水吸收生成硝酸。若向所得硝酸铜溶液中加入5 mol·L-1 NaOH溶液至Cu2+恰好完全沉淀,则消耗NaOH溶液的体积是( )
A.60 mL B.45 mL
C.30 mL D.15 mL
查看答案和解析>>
科目:高中化学 来源: 题型:
聚合硫酸铁又称聚铁,化学式为[Fe2(OH)n(SO4)3-0.5n]m,广泛用于污水处理。实验室利用硫酸厂烧渣(主要成分为铁的氧化物及少量FeS、SiO2等)制备聚铁和绿矾(FeSO4·7H2O),过程如下所示:

(1)验证固体W焙烧后产生的气体中含有SO2的方法是
________________________________________________________________________。
(2)制备绿矾时,向溶液X中加入过量__________,充分反应后,经__________操作得到溶液Y,再经浓缩、结晶等步骤得到绿矾。
(3)溶液Z的pH影响聚铁中铁的质量分数,用pH试纸测定溶液pH的操作方法为________________________________________________________________________。
若溶液Z的pH偏小,将导致聚铁中铁的质量分数________(填“偏大”或“偏小”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
氮是地球上极为丰富的元素。
(1)Li3N晶体中氮以N3-存在,N3-的电子排布式为________________。
(2)N≡N叁键的键能为942 kJ·mol-1,N—N单键的键能为247 kJ·mol-1。计算说明N2中的________键比________键稳定(填“σ”或“π”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
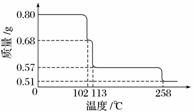
0.80 g CuSO4·5H2O样品受热脱水过程的热重曲线(样品质量随温度变化的曲线)如下图所示。
请回答下列问题:
(1)试确定200 ℃时固体物质的化学式________________________________________
________________________________________________________________________;
(要求写出推断过程)。
(2)取270 ℃所得样品,于570 ℃灼烧得到的主要产物是黑色粉末和一种氧化性气体,该反应的化学方程式为________________________;把该黑色粉末溶解于稀硫酸中,经浓缩、冷却,有晶体析出,该晶体的化学式为________,其存在的最高温度是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
按要求书写电极反应式和总方程式
(1)用惰性电极电解AgNO3溶液:
阳极反应式___________________________________________________;
阴极反应式____________________________________________________;
总反应离子方程式______________________________________________。
(2)用惰性电极电解MgCl2溶液
阳极反应式____________________________________________________;
阴极反应式____________________________________________________;
总反应离子方程式_______________________________________________。
(3)用铁作电极电解NaCl溶液
阳极反应式_____________________________________________________;
阴极反应式_____________________________________________________;
总反应化学方程式_______________________________________________。
(4)用铁作电极电解NaOH溶液
阳极反应式______________________________________________________;
阴极反应式_______________________________________________________;
总反应离子方程式_________________________________________________。
(5)用铜作电极电解盐酸溶液
阳极反应式_________________________________________________________;
阴极反应式_________________________________________________________;
总反应离子方程式__________________________________________________。
(6)用Al作电极电解NaOH溶液
阳极反应式________________________________________________________;
阴极反应式________________________________________________________;
总反应离子方程式__________________________________________________。
(7)以铝材为阳极,电解H2SO4溶液,铝材表面形成氧化膜
阳极反应式________________________________________________________;
阴极反应式_______________________________________________________;
总反应离子方程式___________________________________________________。
(8)用Al单质作阳极,石墨作阴极,电解NaHCO3溶液
阳极反应式__________________________________________________________;
阴极反应式__________________________________________________________;
(9)用惰性电极电解熔融MgCl2
阳极反应式__________________________________________________________;
阴极反应式__________________________________________________________;
总反应离子方程式____________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
使用氯化钠作原料可以得到多种产品。
(1)实验室用惰性电极电解100 mL 0.1 mol·L-1 NaCl溶液,若阴阳两极均得到112 mL气体(标准状况),则所得溶液的物质的量浓度是______________(忽略反应前后溶液体积的变化)。
(2)某学生想制作一种家用环保型消毒液发生器,用石墨作电极电解饱和氯化钠溶液,通电时,为使Cl2被完全吸收,制得有较强杀菌能力的消毒液,设计了如图的装置。

对电源电极名称和消毒液的主要成分判断正确的是________(填字母序号)。
A.a为正极,b为负极;NaClO和NaCl
B.a为负极,b为正极;NaClO和NaCl
C.a为阳极,b为阴极;HClO和NaCl
D.a为阴极,b为阳极;HClO和NaCl
(3)实验室中很难用亚铁盐溶液与烧碱反应制得白色纯净的Fe(OH)2沉淀。某同学利用上图装置,只更换一个电极,通过电解法制取较纯净的Fe(OH)2沉淀,且较长时间不变色。该同学换上的电解材料是__________(用元素符号表示),总的反应式是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
如图所示,将铁棒和石墨棒插入盛有饱和NaCl溶液的U型管中,下列分析正确的是( )
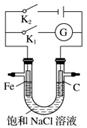
A.K1闭合,铁棒上发生的反应为2H++2e-—→H2↑
B.K1闭合,石墨棒周围溶液pH逐渐升高
C.K2闭合,铁棒不会被腐蚀,属于牺牲阳极的阴极保护法
D.K2闭合,电路中通过0.002NA个电子时,两极共产生0.001 mol气体
查看答案和解析>>
科目:高中化学 来源: 题型:
试比较下列各组ΔH的大小。
(1)同一反应,生成物状态不同时
A(g)+B(g)===C(g) ΔH1<0
A(g)+B(g)===C(l) ΔH2<0
则ΔH1____ΔH2(填“>”、“<”或“=”,下同)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com