
【题目】草酸晶体的组成可用H2C2O4·2H2O(M=126g/mol)表示,其中混有不参与反应的杂质,为了测定草酸晶体的纯度,进行如下实验:称取m g样品,配成250mL水溶液。量取25.00mL所配制的草酸溶液置于锥形瓶内,加入适量稀H2SO4后,用浓度为c mol·L-1的KMnO4溶液滴定,所发生的反应: KMnO4+ H2C2O4+ H2SO4 = K2SO4+ CO2↑+ MnSO4+ H2O.试回答:
(1)写出该反应的离子方程式并配平:_________________________________________,该反应发生时产生气体先慢后快的原因是_______________________________________________
(2)实验中,KMnO4溶液应装在_____式滴定管中,因为 ___________________。
(3)滴定过程中需要加入的指示剂为___________(填指示剂的名称或“不需要”),确定反应达到滴定终点时的现象是______________________________________。
(4)在滴定过程中若用c mol·L-1的KMnO4溶液VmL,则所配制的草酸溶液的物质的量浓度为____________mol·L-1,由此可计算样品中草酸晶体的纯度是________。
【答案】2 MnO4-+5H2C2O4+6H+=10CO2↑+2Mn2++8H2O 生成Mn2+起催化剂 作用,加快反应速率 酸 高锰酸钾溶液具有强氧化性,可腐蚀橡胶管 不需要 溶液由无色变浅红色(粉红色),且半分钟不褪色 cV/10 315cV/m%
【解析】
(1)反应中锰元素化合价降低5价,草酸中碳元素化合价升高1价,则高锰酸根离子和草酸的比例为2:5,则根据质量守恒和电荷守恒得到离子方程式为:2MnO4-+5H2C2O4+6H+=10CO2↑+2Mn2++8H2O。随着反应进行反应物的浓度都在减小,反应速率加快只能是在反应过程中生成的锰离子起催化剂作用,加快了反应速率。(2)高锰酸钾溶液具有强氧化性,可腐蚀橡胶管,所以只能用酸式滴定管。 (3)高锰酸钾溶液有颜色,所以反应过程中不需要指示剂。滴定终点溶液由无色变浅红色(粉红色),且半分钟不褪色。(4) c mol·L-1的KMnO4溶液VmL滴定草酸,根据方程式2MnO4----5H2C2O4分析,设草酸的浓度为xmol/L,
2MnO4----5H2C2O4
2 5
cV x×25
有![]() ,则草酸的浓度为cV/10mol/L。草酸晶体的纯度为
,则草酸的浓度为cV/10mol/L。草酸晶体的纯度为![]() =315cV/m%。
=315cV/m%。


科目:高中化学 来源: 题型:
【题目】营养平衡、科学使用食品添加剂有助于健康和提高免疫力。

(1)维生素C又称抗坏血酸,在氯化铁溶液中加入维生素C后,溶液由黄色转变为浅绿色,说明维生素C具有较强的________性(填“氧化”或“还原”)。
(2)某种食品的配料标签如图所示。该配料中,属于防腐剂的是________,蛋白质在人体内水解的最终产物是氨基酸,氨基酸结构中含有的官能团有氨基和____________(填结构简式)。
(3)“阿司匹林”是一种解热镇痛药,遇潮湿空气或水能缓慢水解生成水杨酸(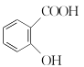 )和醋酸,写出该反应的化学方程式:__________________________。
)和醋酸,写出该反应的化学方程式:__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】计算题
(1)某地产石灰石所含杂质不溶于水也不与盐酸反应。为测定该石灰石中碳酸钙的含量,现进行下列实验:称取25g石灰石放在质量为145g的烧杯中,向其中加入100g稀盐酸,反应恰好完全,此时称量烧杯及其中溶液,总质量为261.2g,求:
①石灰石中碳酸钙的质量为__________克。
②反应后溶液中溶质的质量分数为__________(保留两位有效数字)。
(2)某厂的某钢样粉末28.36 g(假设只含Fe和C),在氧气流中充分反应,将产生的气体通入足量的澄清石灰水中,得到3 g白色沉淀。
①计算可得此钢样粉末中铁和碳的质量之比为__________。
②再取三份不同质量的钢样粉末分别加到50g质量分数相同的硫酸中,充分反应后,测得的实验数据如下表所示:(标准状况下,2克 H2的体积为22.4L)
实验序号 | Ⅰ | Ⅱ | Ⅲ |
加入钢样粉末的质量 / g | 2.836 | 5.672 | 8.508 |
生成气体的体积(标准状况)/ L | 1.12 | 2.24 | 2.80 |
根据表中的数据计算,硫酸溶液中H2SO4溶质的质量分数是__________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列图示所得出的结论不正确的是

A. 图甲是CO(g)+H2O(g)![]() CO2(g)+H2(g)的平衡常数与反应温度的关系曲线,说明该反应的ΔH<0
CO2(g)+H2(g)的平衡常数与反应温度的关系曲线,说明该反应的ΔH<0
B. 图乙是室温下H2O2催化分解放出氧气的反应中c(H2O2 )随反应时间变化的曲线,说明随着反应的进行H2O2分解速率逐渐减小
C. 图丙是室温下用0.1000 mol·L1NaOH溶液滴定20.00 mL 0.1000 mol·L1某一元酸HX的滴定曲线,说明HX是一元强酸
D. 图丁是室温下用Na2SO4除去溶液中Ba2+达到沉淀溶解平衡时,溶液中c(Ba2+ )与c(SO42)的关系曲线,说明溶液中c(SO42 )越大c(Ba2+ )越小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列因果关系不正确的是( )
选项 | 原因 | 结果 |
A | 大量植树造林 | 温室效应 |
B | SO2和NO2气体的大量排放 | 酸雨 |
C | 含氮、磷等生活废水的大量排放 | 水华、赤潮 |
D | 汽车尾气的大量排放 | 光化学烟雾 |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用质量分数为98%的浓硫酸(ρ=1.84 g·cm-3)配制240 mL 1.84 mol·L-1稀硫酸,下列操作正确的是( )
A. 将蒸馏水缓慢注入盛有一定量浓硫酸的烧杯中,并不断搅拌至冷却
B. 必需的定量仪器有100 mL量筒、250 mL容量瓶和托盘天平
C. 量取浓硫酸的体积为25.0 mL
D. 先在容量瓶中加入适量水,将量好的浓硫酸注入容量瓶,加水定容
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用脱脂棉包住约0.2 g过氧化钠粉末,置于石棉网上,往脱脂棉上滴水,可观察到脱脂棉剧烈燃烧起来。
(1)由实验现象所得出的有关Na2O2和H2O反应的结论是:
a.有氧气生成;b._________。
(2)某学校研究性学习小组拟用下图所示装置进行实验,以证明上述结论。
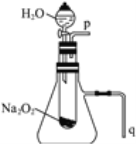
①用以验证结论a的实验操作方法及现象是_________。
②用以验证结论b的实验____________。
(3)该研究性学习小组的同学认为Na2O2和H2O反应可生成H2O2,现请你设计一个简单的实验证明Na2O2和足量的H2O充分反应后的溶液中有H2O2存在。(只要求列出实验所用的试剂及观察到的现象)
试剂:__________。
现象:_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一无色溶液,其中可能含有Fe3+、Al3+、Fe2+、Mg2+、Cu2+、NH4+、K+、CO32-、SO42-等离子的几种,为分析其成分,取此溶液分别进行了四个实验,其操作和有关现象如图所示:

请你根据上图推断:
(1)原溶液中一定存在的阴离子有_______________,显___(填“酸”“碱”或“中”)性。
(2)实验③中产生无色无味气体所发生的化学方程式为__________________________________。
(3)写出实验④中A点对应沉淀的化学式:__________。
(4)写出实验④中,由A→B过程中所发生反应的离子方程式:________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D均为中学化学常见的纯净物,A是单质。它们之间有如下反应关系:
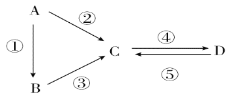
(1)若B是淡黄色固体,反应②③均用到同一种液态氢化物。D物质常用于食品工业。写出反应④的化学方程式: _________________________________。
(2)若B是气态氢化物,C、D是氧化物且会造成光化学烟雾污染。写出反应③的化学方程式: __________________________________________。
(3)若A是太阳能电池用的光伏材料。C、D为钠盐,两种物质中除钠、氧外的元素位于同一主族,且溶液均显碱性。写出反应②的化学方程式: ___________________________。
(4)若D物质具有两性,反应②③均要用强碱溶液,反应④是通入过量的一种引起温室效应的主要气体。写出反应④的离子方程式: ____________________________________。
(5)若A是应用最广泛的金属。反应④用到A,反应②⑤均用到同一种非金属单质。写出反应④的离子方程式: _____________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com