
【题目】对于可逆反应H2(g) + I2(g)![]() 2HI(g),在恒温时由H2(g)和I2(g)开始反应,下列说法正确的是
2HI(g),在恒温时由H2(g)和I2(g)开始反应,下列说法正确的是
A. H2(g)的消耗速率与HI(g)的生成速率比为2:1
B. 增大压强(通过改变体积实现),混合气体的颜色不变
C. 正、逆反应速率的比值是恒定的
D. 达到平衡时,用同种物质表示的正、逆反应速率相等
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】乙醇和乙酸在浓硫酸作用下,通过酯化反应制得乙酸乙酯,反应温度为115~125℃,反应装置如图。下列对该实验的描述错误的是

A. 不能用水浴加热
B. 长玻璃管起冷凝回流作用
C. 提纯乙酸乙酯需要经过水、氢氧化钠溶液洗涤
D. 加入过量乙酸可以提高乙醇的转化率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】晶体硅是良好的半导体材料,多晶硅主要采用SiHCl3还原工艺生产。
(1)硅原子核外有_____种能量不同的电子。氯离子的核外电子排布式为________________________。短周期主族元素中,氯元素及与其相邻元素的原子半径从大到小的顺序是________。
(2)从原子结构角度解释硅元素与氯元素的非金属性强弱________________________。
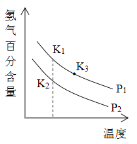
(3)900℃以上发生SiHCl3(g)+H2(g)![]() Si(s)+3HCl(g)反应,平衡时H2的百分含量随温度、压强(P)变化如图(K为不同条件时得平衡常数)。从化学反应速率角度来说明上述反应已达到平衡状态_______。
Si(s)+3HCl(g)反应,平衡时H2的百分含量随温度、压强(P)变化如图(K为不同条件时得平衡常数)。从化学反应速率角度来说明上述反应已达到平衡状态_______。
(4)若反应容器的容积为2L,10min后达到平衡,测得固体的质量增加了2.8g,则HCl的平均反应速率为______________。
(5)P1____P2(选填“>”、“<”或“=”);K1、K2、K3大小关系式为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,通过下列反应可实现燃煤烟气中硫的回收:
SO2(g)+2CO(g)![]() 2CO2(g)+S(l)△H<0 若反应在恒容的密闭容器中进行,下列有关说法正确的是
2CO2(g)+S(l)△H<0 若反应在恒容的密闭容器中进行,下列有关说法正确的是
A. 平衡前,随着反应的进行,容器内压强始终不变
B. 平衡时,其他条件不变,分离出硫,正反应速率加快
C. 平衡时,其他条件不变,升高温度可提高SO2的转化率
D. 其他条件不变,使用不同催化剂,该反应平衡常数不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应A+a B(g)![]() C(g)+2 D(g)(a为化学计量数)。反应过程中,当其他条件不变时,C的百分含量(C%)与温度(T)和压强(P)的关系如下图所示。下列说法正确的是
C(g)+2 D(g)(a为化学计量数)。反应过程中,当其他条件不变时,C的百分含量(C%)与温度(T)和压强(P)的关系如下图所示。下列说法正确的是

A. T2< T1,P2< P1
B. 增加B的物质的量,B的转化率一定增大
C. 若a=2,则A为固态或液态物质
D. 该反应的正反应为吸热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示的装置,电源为Zn-MnO2干电池,其电解质溶液是ZnCl2-NH4Cl混合溶液。X、Y都是惰性电极。将电源接通后,向甲中滴入酚酞溶液,在Fe极附近显红色。试回答下列问题:

(1)在电源中,B电极为________极(填“正极”或“负极”);该极的电极反应是____________。
(2)甲装置中总的化学方程式是______________________________________________。
(3)丙装置在通电一段时间后,X电极上发生的电极反应式是________________________。
(4)如果乙装置中精铜电极的质量增加了0.64g,请问甲装置中,铁电极上产生的气体在标准状况下为___L。
(5)MnO2的生产方法之一是以石墨为电极,电解酸化的MnSO4溶液。阴极的电极反应式是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】次磷酸(H3PO2)是一种精细磷化工产品,属于一元弱酸,具有较强的还原性。下列有关说法正确的是
A. 用惰性电极电解NaH2PO2溶液,其阳极反应式为:2H2O-4e-=O2↑+4H+
B. H3PO2与过量NaOH溶液反应的离子方程式为:H3PO2+3OH-=PO23-+3H2O
C. 将H3PO2溶液加入到酸性重铬酸钾溶液中,H3PO2的还原产物可能为H3PO4
D. H3PO2溶于水的电离方程式为H3PO2![]() H++ H2PO2-
H++ H2PO2-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳元素是组成生物体的最基本元素,这是因为碳元素在生物体中( )
A. 所含的能量最多 B. 最容易被吸收利用
C. 所起的作用最大 D. 构成有机物的骨架
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某强酸性溶液中可以大量共存的离子组是
A.K+、NO3﹣、OH﹣、Cl﹣
B.SO42﹣、Mg2+、Cl﹣、Na+
C.SO42﹣、Na+、Mg2+、SO32﹣
D.Cl﹣、SCN﹣、K+、Fe3+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com