
| A. | CO2、NO2均为酸性氧化物 | B. | 石英、水玻璃均为纯净物 | ||
| C. | NaCl、BaSO4均为强电解质 | D. | 烧碱、纯碱均为碱 |
分析 A.酸性氧化物是能和碱反应生成盐和水的氧化物,且无元素化合价的变化,NO2不是酸性氧化物;
B.水玻璃是硅酸钠的水溶液,是混合物;
C.在水溶液中或熔融状态下能完全电离的电解质属于强电解质;部分电离的是弱电解质;
D.烧碱是碱,纯碱为盐.
解答 解:A.CO2为酸性氧化物,NO2和碱反应生成硝酸钠、亚硝酸钠,发生了氧化还原反应,二氧化氮不符合酸性氧化物的定义,故A错误;
B.石英为纯净物,水玻璃是硅酸钠的水溶液,是混合物,故B错误;
C.NaCl属于盐,在水溶液中或熔融状态下能完全电离,为强电解质,BaSO4固体在熔融状态下,完全电离,属于强电解质,故C正确;
D.烧碱为氢氧化钠属于碱,纯碱是碳酸钠固体,是由钠离子和碳酸根离子组成的,属于盐,故D错误;
故选C.
点评 本题考查物质的分类,掌握相关概念是解答关键就,注意概念的内涵和外延,题目难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
 影响化学反应速率的因素很多,某课外兴趣小组用实验的方法进行探究.
影响化学反应速率的因素很多,某课外兴趣小组用实验的方法进行探究.| 实验步骤 | 现象 | 结论 |
| ①分别取等体积的2mol/L的硫酸于试管中;②分别投入大小、形状相同的Al、Fe、Mg | 反应快慢:Mg>Al>Fe | 反应物的性质越活泼,反应速率越快 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | R为ⅤA族元素 | |
| B. | R的氢化物的水溶液属于强酸 | |
| C. | 氧化剂与还原剂的物质的量之比为5:1 | |
| D. | R2在常温常压下一定是气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


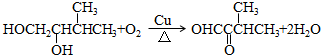 .
.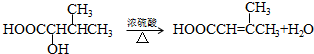 .
. .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4L乙醇含有的分子数为 NA | |
| B. | 1.8g的NH4+离子中含有的电子数为NA | |
| C. | 在含1mol氢氧化铁的胶体中,胶粒数目为NA | |
| D. | 物质的量浓度为0.5mol/L的MgCl2溶液中,含有Cl- 个数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
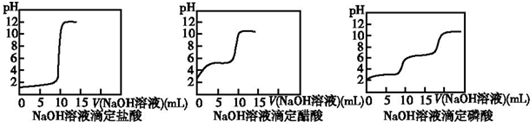
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验目的 | 实验操作 | |
| A | 比较金属性:Mg>Al | 往盛同浓度同体积的盐酸的两试管中分别加入Mg条和Al粉 |
| B | 证明Mg(OH)2沉淀可以转化为Fe(OH)3沉淀 | 向2mL 1mol/L NaOH溶液中先加入3滴1mol/L MgCl2溶液,再加入3滴1mol/L FeCl3溶液 |
| C | 比较氧化性:Fe3+>I- | 往滴有CCl4的FeI2溶液中慢慢滴加氯水 |
| D | 配制1.0mol/L的NaOH溶液 | 称取4g NaOH晶体溶于100mL蒸馏水中 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向一定量的Al2(SO4)3溶液中逐滴加入氨水至过量,反应的离子方程式是Al3++4OH-=AlO2-+2H2O | |
| B. | 向一定量的NaHCO3溶液中加入足量的澄清石灰水,产生白色沉淀,反应的离子方程式是 Ca2++2HCO3-+2OH-=CaCO3↓+CO32-+2H2O | |
| C. | 向适量某溶液中滴入KSCN溶液,溶液变为红色,则该溶液中一定存在Fe3+而不存在Fe2+ | |
| D. | 高锰酸钾酸化要用硫酸而不能用盐酸,其原因是用盐酸酸化会发生反应:10Cl-+2MnO4-+16H+=5Cl2↑+2Mn2++8H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com