
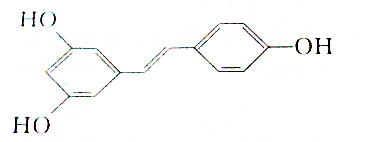
 ,则白藜芦醇的分子式为C14H12O3.
,则白藜芦醇的分子式为C14H12O3.  名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
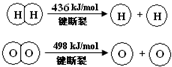
| A. | 该反应原理可用于设计氢氧燃料电池 | |
| B. | 破坏1 mol H-O键需要的能量是463.4 kJ | |
| C. | H2O(g)═H2(g)+$\frac{1}{2}$O2(g)△H=+241.8 kJ/mol | |
| D. | H2(g)中的H-H键能比H2O(g)中的H-O键能大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2SO4 | B. | (NH4)2SO4 | C. | NH3•H2O | D. | NH4HSO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
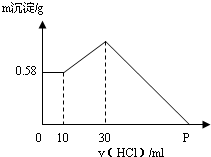 把NaOH、AlCl3、MgCl2三种固体组成的混合物溶于足量水中后,有0.58g白色沉淀,在所得浊液中逐滴加入0.5mol/L盐酸,加入盐酸体积与生成沉淀的质量关系如图所示.试求:
把NaOH、AlCl3、MgCl2三种固体组成的混合物溶于足量水中后,有0.58g白色沉淀,在所得浊液中逐滴加入0.5mol/L盐酸,加入盐酸体积与生成沉淀的质量关系如图所示.试求:查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | Cl-,Mg2+,K+,SO42- | B. | NH4+,Cl-,Na+,Ba2+ | ||
| C. | Fe2+,NO3-,Cl-,Na+ | D. | HCO3-,K+,NH4+,SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下CH3COONa某溶液的pH=8 | |
| B. | 用CH3COOH溶液做导电实验,灯泡很暗 | |
| C. | 等pH等体积的盐酸、CH3COOH溶液分别与足量锌反应,CH3COOH放出的氢气较多 | |
| D. | 0.1mol•L-1的CH3COOH溶液中含有CH3COOH、CH3COO-、H+、OH- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com