
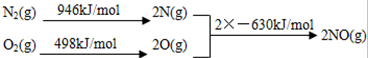
| A. | 含有金属阳离子的晶体一定是离子晶体 | |
| B. | 化合物硫氰化铁和氢氧化二氨合银中都存在配位键 | |
| C. | KCl、HF、CH3CH2OH、SO2都易溶于水,且原因相同 | |
| D. | MgO的熔点比NaCl的高,主要是因为MgO的晶格能大于NaCl的晶格能. |
分析 A.含有金属阳离子的晶体可能是金属晶体;
B.硫氰化铁是铁离子和硫氰根离子形成的配位化合物;
C.KCl、HF、CH3CH2OH、SO2都易溶于水,但原因不完全相同,二氧化硫和水反应;
D.均为离子晶体,晶格能大的熔点高,晶格能与离子半径与离子电荷有关.
解答 解:A.含有金属阳离子的晶体可能是金属晶体,如Fe、Cu等,故A错误;
B.硫氰化铁是铁离子和硫氰根离子形成的配位化合物,氢氧化二氨合银含有配位键、离子键和共价键,故B正确;
C.KCl、HF、CH3CH2OH、SO2都易溶于水,二氧化硫和水生成亚硫酸,氟化氢、乙醇和水形成氢键,氯化钠在水溶液里电离,所以其原因不同,故C错误;
D.决定晶格能的因素为:离子电荷、离子半径、离子的电子层构型,MgO所带电荷多,MgO的熔点高于NaCl,故D正确.
故选BD.
点评 本题考查化学键的判断,为高频考点,把握离子键和共价键、配位键的形成为解答的关键,知道配位键的形成、氢键对物质溶解性的影响等知识点,题目难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| 元素代号 | L | M | Q | R | T |
| 原子半径/nm | 0.160 | 0.143 | 0.089 | 0.104 | 0.066 |
| 主要化合价 | +2 | +3 | +2 | +6、-2 | -2 |
| A. | 氢化物的沸点为H2T<H2R | B. | 单质与稀盐酸反应的快慢为L<Q | ||
| C. | M与T形成的化合物是离子化合物 | D. | L2+与R2-的核外电子数相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 离子 | K+ | Na+ | NH4+ | SO42- | NO3- | Cl- |
| 浓度/mol•L-1 | 4×10-6 | 6×10-6 | 2×10-5 | 4×10-5 | 3×10-5 | 2×10-5 |
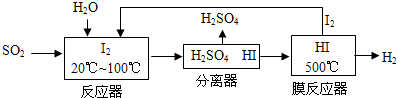
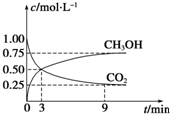
| 温度/℃ | 0 | 100 | 200 | 300 | 400 |
| 平衡常数 | 667 | 13 | 1.9×10-2 | 2.4×10-4 | 1×10-5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 聚乙烯食品包装袋、食物保鲜膜都是无毒的高分子材料 | |
| B. | 高温能杀死流感病毒是因为构成病毒的蛋白质受热变性 | |
| C. | 太阳能电池板中的硅是硅单质,光导纤维的主要成分是二氧化硅 | |
| D. | 明矾[KAl(SO4)2•12H2O]常用于自来水的净化、杀菌消毒 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Y、Z、R元素简单离子的半径依次增大 | |
| B. | 含有Y、Z、R三种元素的化合物最多只有2种 | |
| C. | 元素W和R最高价氧化物对应水化物的酸性后者强 | |
| D. | Y与Z形成的两种化合物中的化学键类型和阴阳离子个数比均相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 为防止食品氧化变质,食品袋中放有硅胶包 | |
| B. | 酒精用来杀菌消毒,利用了乙醇的氧化性 | |
| C. | 植物油与矿物油可以通过水解反应区分 | |
| D. | 明矾净水时发生了化学及物理变化,能起到杀菌、消毒的作用 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
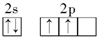 b.
b.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 物质 | 杂质 | 试剂 | 提纯方法 | |
| A | 苯 | 苯酚 | 溴水 | 过滤 |
| B | 二氧化碳 | 二氧化硫 | 饱和碳酸钠溶液 | 洗气 |
| C | 乙酸乙酯 | 乙酸 | 稀氢氧化钠溶液 | 混合振荡、静置分液 |
| D | 蛋白质 | 蔗糖 | 饱和硫酸铵溶液 | 盐析、过滤、洗涤 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 澄清石灰水与少量小苏打溶液混合:Ca2++2OH-+2HCO3-=CaCO3↓+CO32-+2H2O | |
| B. | 磁性氧化铁溶于氢碘酸:Fe3O4+8HI=2Fe3++Fe2++4H2O+8I- | |
| C. | NaHSO4溶液中滴加过量的Ba(OH)2溶液:H++SO42-+Ba2++OH-=BaSO4↓+H2O | |
| D. | 醋与氨水混合:CH3COOH+NH3?H2O=CH3COONH4+H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com