
| 1 |
| 2 |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| ① | ② | ③ | ④ |
| 0.1mol?L-1氨水 | Ph=11 氨水 |
0.1mol?L-1 盐酸 |
pH=3 盐酸 |
| A、由水电离出的c(H+):③>① |
| B、①稀释到原来的100倍,pH与②相同 |
| C、①与③混合,若溶液pH=7,则溶液中c(NH4+)>C(Cl-) |
| D、②与④等体积混合,混合液pH>7 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 某研究性学习小组用0.20mol?L-1的标准NaOH溶液滴定未知浓度的盐酸,其实验探究操作为如下几步:
某研究性学习小组用0.20mol?L-1的标准NaOH溶液滴定未知浓度的盐酸,其实验探究操作为如下几步:查看答案和解析>>
科目:高中化学 来源: 题型:
| 物质组 | 不属于同类的物质 | 理由 |
| (1)Mg、O2、N2、NO | ||
| (2)NaOH、Na2CO3、CH4、KCl | ||
| (3)H2CO3、H2SO4、NH3?H2O、H2SiO3 | ||
| (4)CaO、SO2、CO2、SiO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
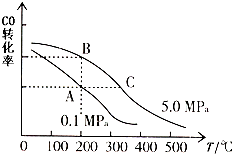 在一恒容的密闭容器中,由CO和H2合成甲醇:CO(g)+2H2(g)═CH3OH(g)△H
在一恒容的密闭容器中,由CO和H2合成甲醇:CO(g)+2H2(g)═CH3OH(g)△H查看答案和解析>>
科目:高中化学 来源: 题型:
 在①CO2、②NO2、③CO、④Cl2、⑤HCl、⑥NH3等气体中(选填序号)
在①CO2、②NO2、③CO、④Cl2、⑤HCl、⑥NH3等气体中(选填序号)查看答案和解析>>
科目:高中化学 来源: 题型:
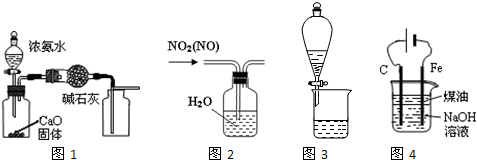
| A、用图1装置制取并收集干燥纯净的NH3 |
| B、用图2所示装置可除去NO2中的NO |
| C、用图3所示装置可分离CH3COOC2H5和饱和碳酸钠溶液 |
| D、用图4装置制备Fe(OH)2并能较长时间观察其颜色 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、常温下,23g NO2含有NA个氧原子 |
| B、25℃、101.3kPa时,11.2L H2中含有的原子数为NA |
| C、标准状况下,22.4L H2O中含有的分子数为NA |
| D、2.3g的金属钠变为钠离子时失去的电子数为0.1NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com