
分析 (1)含自由移动的离子或电子的物质能导电;在水溶液中或熔融状态下能导电的化合物为电解质;在水溶液中和熔融状态下均不能导电的化合物为非电解质;在水溶液中能完全电离的为强电解质,只能部分电离的为弱电解质;
(2)NaCl是强电解质,能完全电离为钠离子和氯离子;
CH3COOH是弱电解质,只能部分电离为氢离子和醋酸根,据此分析.
解答 解:(1)①盐酸是混合物,既不是电解质也不是非电解质,含自由移动的离子,故能导电;
②熔融NaCl含自由移动的离子,故能导电,是电解质,且是强电解质;
③石墨是单质,能导电,但既不是电解质也不是非电解质;
④CO2是非电解质,不能导电;
⑤AgCl不能导电,是电解质中的强电解质;
⑥CH3COOH不能导电,是电解质中的弱电解质;
⑦NaOH溶液是混合物,能导电,但既不是电解质也不是非电解质;
⑧Al2O3 不能导电,是电解质中的强电解质;
⑨酒精是非电解质;
故答案为:①②③⑦;②⑤⑥⑧;④⑨;②⑤⑧;⑥;
(2)NaCl是强电解质,能完全电离为钠离子和氯离子,电离方程式为:NaCl=Na++Cl-,故答案为:NaCl=Na++Cl-;
CH3COOH是弱电解质,只能部分电离为氢离子和醋酸根,故用可逆号,故电离方程式为:CH3COOH?CH3COO-+H+.故答案为:CH3COOH?CH3COO-+H+;
点评 本题考查了电解质、非电解质、强弱电解质的区别以及电离方程式的书写,应注意强电解质和弱电解质的本质区别是电离程度,和溶解度无关.


 名校通行证有效作业系列答案
名校通行证有效作业系列答案科目:高中化学 来源: 题型:选择题
| A. | 2H2(g)+O2(g)=2H2O(l);△H1 2H2(g)+O2(g)=2H2O(g);△H2 | |
| B. | S(g)+O2(g)=SO2(g);△H1 S(s)+O2(g)=SO2(g)△H2 | |
| C. | H2(g)+Cl2(g)=2HCl(g);△H1 $\frac{1}{2}$H2(g)+$\frac{1}{2}$Cl2(g)=HCl(g);△H2 | |
| D. | C(s)+$\frac{1}{2}$O2(g)=CO(g);△H1 C(s)+O2(g)=CO2(g);△H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+的电子排布图: | B. | Na+的结构示意图: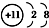 | ||
| C. | Na的电子排布式:1s22s22p63s1 | D. | Na的简化电子排布式:[Ne]3s1 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2CO3浓度减小 | B. | Na2CO3浓度增大 | ||
| C. | Na2CO3浓度增大,并有晶体析出 | D. | Na2CO3浓度不变,并有晶体析出 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 NaH2PO4、Na2HPO4可用于合成化工原料三聚磷酸钠(Na5P3O10).
NaH2PO4、Na2HPO4可用于合成化工原料三聚磷酸钠(Na5P3O10).| 滴定次数 | 待测溶液A的体积(/mL) | 0.1000mol•L-1NaOH溶液的体积 | |
| 滴定前读数(/mL) | 滴定后读数(/mL) | ||
| 1 | 25.00 | 1.02 | 21.03 |
| 2 | 25.00 | 2.00 | 21.99 |
| 3 | 25.00 | 0.20 | 20.20 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com