
| 催化剂 |
| △ |
| 催化剂 |
| △ |
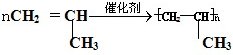 ,
,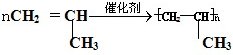 ;
;| Fe |
| Fe |
| 催化剂 |
| △ |
| 催化剂 |
| △ |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| A、电解NaOH溶液时,溶液浓度将减小,pH不变 |
| B、电解H2SO4溶液时,溶液浓度将增大,pH不变 |
| C、电解Na2SO4溶液时,溶液浓度将增大,pH不变 |
| D、电解NaCl溶液时,溶液浓度将减小,pH不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 在高中阶段化学学科中所涉及的平衡理论主要包括:化学平衡、电离平衡、水解平衡和难溶电解质溶解平衡四种,均符合勒夏特列原理,它们在工农业生产中都有广泛的应用.请回答下列问题:
在高中阶段化学学科中所涉及的平衡理论主要包括:化学平衡、电离平衡、水解平衡和难溶电解质溶解平衡四种,均符合勒夏特列原理,它们在工农业生产中都有广泛的应用.请回答下列问题:| n(NH3) |
| n(CO2) |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 乙醇是目前很多小火锅常用的燃料,其结构如图:
乙醇是目前很多小火锅常用的燃料,其结构如图:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、无法确定样品中钠、硫元素的质量比 |
| B、Na2SO3已被氧化 |
| C、加入Ba(NO3)2溶液后,生成的沉淀中一定含有BaSO4 |
| D、加入稀硝酸后的沉淀一定是BaSO4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com