
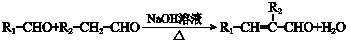
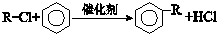
 .
.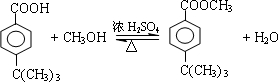 .
.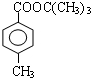 、
、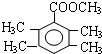 .(写出两种即可)
.(写出两种即可)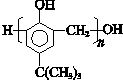 ,合成路线是
,合成路线是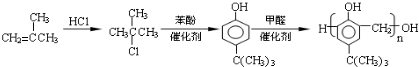 .
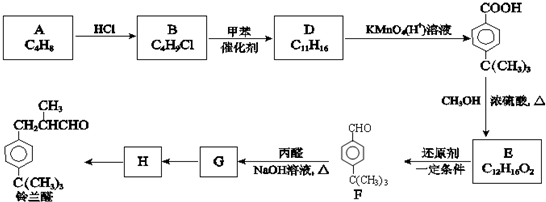
.分析 由A、B的分子式判断A到B的反应是加成反应,由B、D的分子式可知,反应类似已知ii中取代反应反应,由D被酸性高锰酸钾溶液氧化的产物的结构,可知D的结构简式为 ,可推知C4H8为CH2=C(CH3)2,C4H9Cl为(CH3)3CCl.生成E的反应是酯化反应,则E的结构简式为
,可推知C4H8为CH2=C(CH3)2,C4H9Cl为(CH3)3CCl.生成E的反应是酯化反应,则E的结构简式为 ,F的结构简式为
,F的结构简式为 ,F到G发生类似已知i的反应,结合铃兰醛的结构,可知G的结构简式为
,F到G发生类似已知i的反应,结合铃兰醛的结构,可知G的结构简式为 ,G到铃兰醛的转化中碳碳双键被消除,则G与氢气发生加成反应生成H为
,G到铃兰醛的转化中碳碳双键被消除,则G与氢气发生加成反应生成H为 ,H再发生催化氧化生成铃兰醛.
,H再发生催化氧化生成铃兰醛.
(5)根据目标物的结构可知,应是HCHO与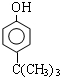 发生缩聚反应,A为2-甲基丙烯,与氯化氢加成生成2-甲基-2-氯丙烷,与苯酚发生类似已知ii的反应,其产物再与甲醛发生缩聚反应即可.
发生缩聚反应,A为2-甲基丙烯,与氯化氢加成生成2-甲基-2-氯丙烷,与苯酚发生类似已知ii的反应,其产物再与甲醛发生缩聚反应即可.
解答 解:由A、B的分子式判断A到B的反应是加成反应,由B、D的分子式可知,反应类似已知ii中取代反应反应,由D被酸性高锰酸钾溶液氧化的产物的结构,可知D的结构简式为 ,可推知C4H8为CH2=C(CH3)2,C4H9Cl为(CH3)3CCl.生成E的反应是酯化反应,则E的结构简式为
,可推知C4H8为CH2=C(CH3)2,C4H9Cl为(CH3)3CCl.生成E的反应是酯化反应,则E的结构简式为 ,F的结构简式为
,F的结构简式为 ,F到G发生类似已知i的反应,结合铃兰醛的结构,可知G的结构简式为
,F到G发生类似已知i的反应,结合铃兰醛的结构,可知G的结构简式为 ,G到铃兰醛的转化中碳碳双键被消除,则G与氢气发生加成反应生成H为
,G到铃兰醛的转化中碳碳双键被消除,则G与氢气发生加成反应生成H为 ,H再发生催化氧化生成铃兰醛.
,H再发生催化氧化生成铃兰醛.
(1)由A、B的分子式判断A到B的反应是加成反应,由上述分析可知,D的结构简式是 ,
,
故答案为:加成反应; ;
;
(2)生成E的反应是酯化反应,化学方程式为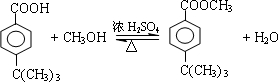 ,
,
故答案为: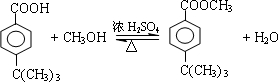 ;
;
(3)由上述分析可知,G的结构简式为 ,
,
a.G分子中有6种不同化学环境的氢原子,故a错误;
b.G分子中存在醛基、碳碳双键、苯环,所以能发生加聚反应、氧化反应和还原反应,故b正确;
c.醛基、碳碳双键、苯环都可以与氢气加成,所以1 mol G最多能与5mol H2发生加成反应,故c错误,
故答案为:b;
(4)E( )有多种芳香簇的同分民构体,符合下列条件的同分异构体:a.能发生水解,说明含有酯基,b.只有四种等效氢,可能的结构简式为:
)有多种芳香簇的同分民构体,符合下列条件的同分异构体:a.能发生水解,说明含有酯基,b.只有四种等效氢,可能的结构简式为: 、
、 ,
,
故答案为: 、
、 ;
;
(5)根据目标物的结构可知,应是HCHO与 发生缩聚反应,A为2-甲基丙烯,与氯化氢加成生成2-甲基-2-氯丙烷,与苯酚发生类似已知ii的反应,其产物再与甲醛发生缩聚反应即可,合成类型流程图为:
发生缩聚反应,A为2-甲基丙烯,与氯化氢加成生成2-甲基-2-氯丙烷,与苯酚发生类似已知ii的反应,其产物再与甲醛发生缩聚反应即可,合成类型流程图为: ,
,
故答案为: .
.
点评 本题考查有机物的推断与合成,充分利用有机物的分子式与结构进行分析解答,需要学生熟练掌握官能团的性质与转化,侧重考查学生分析推理能力、自学能力与知识迁移应用,难度中等


科目:高中化学 来源: 题型:实验题
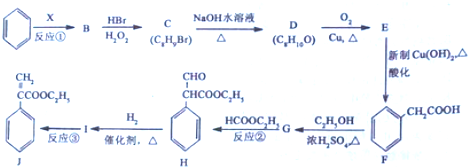
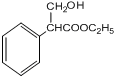 $→_{△}^{浓硫酸}$
$→_{△}^{浓硫酸}$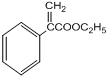 +H2O,反应类型是消去反应.
+H2O,反应类型是消去反应.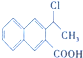 为起始原料制备
为起始原料制备 的合成路线(无机试剂任用).合成路线示例如下:H2C=CH2$\stackrel{HBr}{→}$CH3CH2Br$→_{△}^{NaOH溶液}$CH3CH2OH.
的合成路线(无机试剂任用).合成路线示例如下:H2C=CH2$\stackrel{HBr}{→}$CH3CH2Br$→_{△}^{NaOH溶液}$CH3CH2OH.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
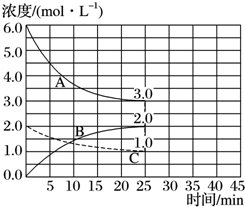 (1)目前工业合成氨的原理是N2(g)+3H2(g)?2NH3(g)△H=-93.0kJ•mol-1.
(1)目前工业合成氨的原理是N2(g)+3H2(g)?2NH3(g)△H=-93.0kJ•mol-1.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化学变化一定会产生新的核素 | |
| B. | 明矾净水过程涉及化学变化 | |
| C. | 催化剂能改变化学反应的活化能和焓变 | |
| D. | 在实验室里用铁屑、氧化铜、稀硫酸为原料制备铜,有下列两种途径: 途径a:Fe$\stackrel{H_{2}SO_{4}}{→}$H2$→_{△}^{Cu}$Cu 途径b:CuO$\stackrel{H_{2}SO_{4}}{→}$CuSO4$\stackrel{Fe}{→}$Cu 实际操作中,制得等质量的铜时,途径a和途径b消耗Fe的质量一定相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 在0.1 mol•L-1NaHCO3溶液中:c(Na+)>c(HCO3-)>c(CO32-)>c(H2CO3) | |
| B. | 在0.1 mol•L-1NaClO溶液中:c(OH-)=c(H+)+c(HClO) | |
| C. | 25℃时,0.1 mol•L-1CH3COOH溶液中滴入NaOH溶液,使溶液pH=7时:c(CH3COO-)=c(Na+)>c(H+)=c(OH-) | |
| D. | 已知酸性:HCOOH>CH3COOH,浓度均为0.1 mol•L-1的HCOOK与CH3COONa溶液中:c(K+)-c(HCOO-)>c(Na+)-c(CH3COO-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲烷分子的球棍模型: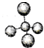 | B. | NH4Br的电子式: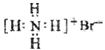 | ||
| C. | 氯原子的结构示意图: | D. | 邻羟基苯甲酸的结构简式: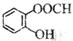 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 高锰酸钾溶液与乙二酸(草酸)反应:2MnO4-+5C2O42-+16H+→2Mn2++10CO2↑+8H2O | |
| B. | 苯酚与碳酸钠溶液: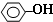 +CO32-→ +CO32-→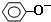 +H2CO3 +H2CO3 | |
| C. | 等体积等物质的量浓度的NH4Fe(SO4)2和Ba(OH)2混合:2Fe3++3SO42-+3Ba2++6OH-═3BaSO4↓+2Fe(OH)3↓ | |
| D. | 在强碱性溶液中次氯酸钠与Fe(OH)3反应生成Na2FeO4:3ClO-+2Fe(OH)3═2FeO42-+3Cl-+H2O+4H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 步骤 | 试剂及操作 | 现 象 |
| i | 取2 mL BaCl2溶液,滴加2滴0.1 mol•L-1KSCN溶液和5滴5% H2O2溶液 | 生成白色沉淀 |
| ii | 向i所得溶液中滴加0.1mol•L-1 FeCl3溶液 | 无明显现象 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com