
| A. | A | B. | B | C. | C | D. | D |
 期末集结号系列答案
期末集结号系列答案科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
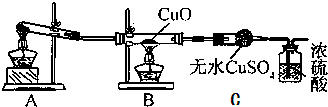
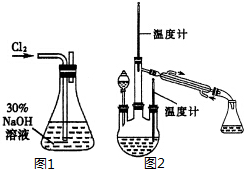 肼是重要的化工原料.某探究小组利用下列反应制取水合肼(N2H4•H2O).
肼是重要的化工原料.某探究小组利用下列反应制取水合肼(N2H4•H2O).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溴苯中混有溴,加入KI溶液,振荡,用汽油萃取出I2 | |
| B. | 除去乙醇中的微量水可加入金属钠,使其完全反应 | |
| C. | 乙酸乙酯中有乙酸杂质,可以加入氢氧化钠溶液,充分反应后静置分液 | |
| D. | 乙烯中混有CO2和SO2,将其通过盛有NaOH溶液的洗气瓶,再干燥 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | O2+4H++4e-=2H2O | B. | O2+2H2O+4e-=4OH- | ||
| C. | N2H4+4OH--4e-=N2+4H2O | D. | N2H4+4H++2e-=2NH4+ |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 化学键的断裂和形成是化学反应能量变化的主要原因 | |
| B. | 伴有能量变化的物质变化都是化学变化 | |
| C. | 在一个确定的化学反应中,反应物的总能量与生成物的总能量一定不同 | |
| D. | 在一个确定的化学反应中,反应物的总能量总是高于生成物的总能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=14的溶液 | |
| B. | c(OH-)=1.0×10-13mol•L-1的溶液 | |
| C. | 0.6%的醋酸(ρ=1g•cm-3) | |
| D. | pH=2的盐酸与pH=12的氢氧化钡溶液等体积混合后所得溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | CH3CH2OH→CH3COOCH2CH3 | B. | CH2=CH2→CH3-CH2Br | ||
| C. | CH2=CH2+H2O $\stackrel{催化剂}{→}$ CH3CH2OH | D. |  → → |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com