

| ||
| ||


科目:高中化学 来源: 题型:
据统计,每年世界上银总消耗量的40%用于感光材料的生产,感光材料经曝光、显影、定影后,黑白片上的银80%左右进入定影液,彩色片上的银几乎全部进入废定影液,所以废定影液中银的含量是十分惊人的。
某研究性学习小组拟对某照相公司的废定影液进行实验处理,回收其中的银和溴。
(一) 资料支撑:
① 定影液(硫代硫酸钠,Na2S2O3)跟胶片或相纸上没有感光部分的溴化银反应,反应方程式为:AgBr(s)+ 2Na2S2O3(aq) = Na3[Ag(S2O3)2](aq) + NaBr(aq)。
② 在酸的作用下,Na3[Ag(S2O3)2]能转化为不溶性的Ag2S。反应原理为:
6HCl+2Na3[Ag(S2O3)2]=6NaCl+Ag2S↓+3S↓+3SO2↑+H2SO4+2H2O。
③溶液中有少量溴化银,可用锌将其还原出来。
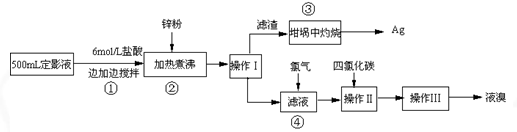
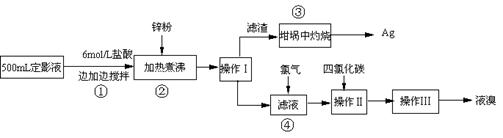
(二) 实验程序设计
(三) 试回答下列问题
(1)本实验需用6mol/L的盐酸250mL,配制时除需量筒、烧杯、玻璃棒外,还需用的仪器有: 、 。
(2)指出流程图中操作所包含的装置是(填序号:A、B、C)Ⅰ Ⅱ Ⅲ 。

(3)步骤③是在空气中灼烧的。该反应的化学方程式: 。实验操作时,加入适量的硝酸钾加盖后再灼热,加硝酸钾的目的可能是: 。
(4)加入锌粉发生的离子反应为: 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com