
| A. | NaOH+HCl═NaCl+H2O | B. | 2Fe3++Fe═3Fe2+ | ||
| C. | Zn+2HCl═ZnCl2+H2↑ | D. | 4Al+3O2+6H2O═4Al(OH)3↓ |
分析 能够设计成原电池的反应必须属于自发进行的氧化还原反应,据此根据各选项中是否存在化合价变化进行判断.
解答 解:A.NaOH+HCl═NaCl+H2O为中和反应,不属于氧化还原反应,不能设计成原电池,故A正确;
B.2Fe3++Fe═3Fe2+为自发进行的氧化还原反应,能够设计成原电池,故B错误;
C.Zn+2HCl═ZnCl2+H2↑为置换反应,属于自发进行的氧化还原反应,能够设计成原电池,故C错误;
D.4Al3O2+6H2O═4Al(OH)3↓为自发进行的氧化还原反应,能够设计成原电池,故D错误;
故选A.
点评 本题考查原电池设计,题目难度不大,明确原电池原理及原电池反应特点是解本题关键,注意原电池反应限制性条件“自发进行、放热、氧化还原反应”,知道常见反应的反应热、常见的氧化还原反应.


 通城学典默写能手系列答案
通城学典默写能手系列答案科目:高中化学 来源: 题型:选择题
| A. | Fe2O3 | B. | FeO | C. | Fe(OH)2 | D. | Fe(OH)3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用氨水洗涤试管内壁上的“银镜” | |
| B. | 只用溴水鉴别苯、CCH4、KI溶液、Na2SO4溶液 | |
| C. | 为加快过滤速度,用玻璃棒搅拌过滤器中的食盐水 | |
| D. | 为迅速除去乙酸乙酯中的少量乙酸,加入足量NaOH溶液并加热 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 丙烷 | B. | 新戊烷 | C. | 正丁烷 | D. | 异丁烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1mol/LCH3COOH溶液中:c(CH3COO-)+c(CH3COOH)=0.1mol/L | |
| B. | Na2S溶液中:c(OH-)=c(H+)+c(HS-)+2c(H2S) | |
| C. | 配制FeCl3溶液,应加少量盐酸 | |
| D. | 将Al2(SO4)3溶液蒸干,灼烧得Al2O3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
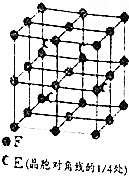 A、B、C、D、E、F为元素周期表前四周期元素且原子序数依次增大,A的基态原子有3个不同的能级,各能级中电子数相等;B2-、C-、D+、E3+具有相同的电子构型;D元素的焰色反应呈黄色;F的基态原子的价电子排布式为3d64s2.
A、B、C、D、E、F为元素周期表前四周期元素且原子序数依次增大,A的基态原子有3个不同的能级,各能级中电子数相等;B2-、C-、D+、E3+具有相同的电子构型;D元素的焰色反应呈黄色;F的基态原子的价电子排布式为3d64s2. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯水是指氯气的水溶液 | |
| B. | 在pH试纸上滴新制氯水,试纸会先变红后褪色 | |
| C. | 久置的氯水漂白作用更强 | |
| D. | 新制氯水应避光保存 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 等于10秒 | B. | 等于12秒 | C. | 大于12秒 | D. | 小于12秒 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com