
����Ŀ����1��ij�¶�ʱ��ˮ�����ӻ�ΪKW��1��10��13������¶�___25��(������������������������)���ڴ��¶��£�ij��Һ����ˮ���������H��Ũ��Ϊ1��10��10mol/L�������Һ��pH����Ϊ_____��
��2�����¶�Ϊ25��ʱ�����ΪVa��pH��a��H2SO4�����ΪVb��pH��b��NaOH��ϣ�ǡ���к͡���֪Va��Vb����a��0.5b������Һ�и������ӵ�Ũ���ɴ�С������˳���ǣ�____��a��ȡֵ��Χ____��
���𰸡��� 3��10 c(Na��)��c(SO42-)��c(H��)��c(OH��) ![]() ��a��7
��a��7
��������
��1��KW���¶����߶�����10��13��10��14(25��ʱ)���ʸ��¶ȸ���25��������Һ�Լ���ʱpH��10������Һ������ʱc(H��)��![]() ��10��3mol/L��pH��3��
��10��3mol/L��pH��3��
�������� 3��10
��2��Na2SO4��Һ������Ũ������Ϊ��c(Na��)��2c(SO42-)������Һ�����ԣ�c(H��)��c(OH��)����ǡ���кͣ���10��aVa��10b��14Vb��![]() ��10a��b��14��1����a��b��14��0��a��b��14������a��0.5b����a��
��10a��b��14��1����a��b��14��0��a��b��14������a��0.5b����a��![]() ����b��7����a��0.5b��
����b��7����a��0.5b��![]() ��a��
��a��![]() ����a��7���ʷ�ΧΪ
����a��7���ʷ�ΧΪ![]() ��a��7��
��a��7��
����c(Na��)��c(SO42-)��c(H��)��c(OH��) ��![]() ��a��7��
��a��7��


 ��ĩ���100�ִ��½����ȫ�Ծ�ϵ�д�
��ĩ���100�ִ��½����ȫ�Ծ�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��![]() ��
��![]() ��
��![]() ��
��![]() ��S��P��Ԫ�س����ڻ������ϵĺϳɡ��ش��������⣺
��S��P��Ԫ�س����ڻ������ϵĺϳɡ��ش��������⣺
(1)��ԭ�ӵĻ�̬�����Ų�ʽΪ_______________________��
(2)![]() ��________���ֲ�ͬ���˶�״̬�ĵ��ӣ�
��________���ֲ�ͬ���˶�״̬�ĵ��ӣ�![]() ��
��![]() ���ȶ���ԭ����_________��
���ȶ���ԭ����_________��
(3)��Ϊ��������Ԫ�أ�����Ԫ��������壬������Ԫ�صĵ縺�ԴӴ�С��˳��Ϊ_________(��Ԫ�ط��ű�ʾ)��
(4)![]() ���۵�Ϊ340�棬����������������
���۵�Ϊ340�棬����������������![]() ����______���塣
����______���塣![]() �Ŀռ乹��Ϊ_____��
�Ŀռ乹��Ϊ_____��
(5) ![]() ����������������ӽṹ��ͼ����ʾ��
����������������ӽṹ��ͼ����ʾ��![]() ������S���ӻ���ʽΪ______��ÿ��
������S���ӻ���ʽΪ______��ÿ��![]() �����к��еŵ��ӶԵ���ĿΪ_________��
�����к��еŵ��ӶԵ���ĿΪ_________��


(6)ͭ��ij�������ᄃ���ṹ��ͼ����ʾ����������Ļ�ѧʽΪ____________�����þ����ı߳�Ϊ![]() �������ӵ�����ֵΪ
�������ӵ�����ֵΪ![]() �������������ܶ�Ϊ_________
�������������ܶ�Ϊ_________![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����Ĵ������ǹ�ҵ���������Ҫ��Ӧ��4NH3��5O2![]() 4NO��6H2O�����ڸ÷�Ӧ�ж���ȷ����
4NO��6H2O�����ڸ÷�Ӧ�ж���ȷ����
A. ��������ԭB. �÷�Ӧ���û���Ӧ
C. ������������D. ����17 g���μӷ�Ӧ����Ӧ��ת��10 mol����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����![]() Ϊ�����ӵ������������й�˵����ȷ����( )
Ϊ�����ӵ������������й�˵����ȷ����( )
A.![]() ��
��![]() ��Һ��
��Һ��![]() ��
��![]() ������֮��Ϊ
������֮��Ϊ![]()
B.�����£�![]() ��
��![]() ��Һ�У����������ˮ������Ϊ
��Һ�У����������ˮ������Ϊ![]()
C.����ȼ�ϵ�ظ�������![]() ����ʱ����·��ת�Ƶĵ�����Ϊ
����ʱ����·��ת�Ƶĵ�����Ϊ![]()
D.�����Ե缫���![]() ��Һ���������
��Һ���������![]() ��ʹ��Һ��ԭ�����·��ת�Ƶĵ�����Ϊ
��ʹ��Һ��ԭ�����·��ת�Ƶĵ�����Ϊ![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ��������������MnO2�ͺ���4 mol���ʵ�Ũ�����ַ�Ӧ������������˵����ȷ����(����)
A. ��ʵ���й�����1 mol MnO2������1 mol����
B. Ϊ�˳�ȥ�����л��е��������壬��������ͨ������ʳ��ˮ�ͼ�ʯ��
C. �ڸ÷�Ӧ��MnO2����������Ũ��������ԭ��
D. ���������������ſ���������ˮ���ռ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��2SO2(g)��O2(g)![]() 2SO3(g)��Ӧ���̵������仯��ͼ��ʾ����֪1molSO2(g)����Ϊ1molSO3(g)����H����99kJ/mol.
2SO3(g)��Ӧ���̵������仯��ͼ��ʾ����֪1molSO2(g)����Ϊ1molSO3(g)����H����99kJ/mol.
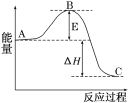
��ش��������⣺
��1��ͼ��A��C�ֱ��ʾ___��___��E�Ĵ�С�Ը÷�Ӧ�ķ�Ӧ������Ӱ�죿____���÷�Ӧͨ����V2O5����������V2O5��ʹͼ��B�������ǽ��ͣ�___��������____��
��2��ͼ����H��___kJ/mol.
��3��V2O5�Ĵ�ѭ����������Ϊ��V2O5����SO2ʱ����������ԭΪ�ļ۷�������ļ۷��������ٱ�����������д���ô�ѭ�������Ļ�ѧ����ʽ��____��
��4�������Ӧ����v(SO2)Ϊ0.05mol/(L��min)����v(O2)��___mol/(L��min)��v(SO3)��____mol/(L��min)��
��5����֪�������ȼ����Ϊ296kJ/mol��������S(s)����3molSO3(g)����H(Ҫ��������)��____
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijѧϰС��̽�����Ļ�ԭ�Լ������������ʣ�����ͼװ�ý���ʵ��(ͼ�мг�װ������ȥ)����B�����������������������ȣ��ٹ����������֪����ˮ�Ȼ��ƿ����հ�����ˮ���ش��������⣺
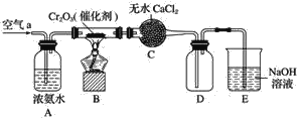
(1)B�з�����Ӧ�Ļ�ѧ����ʽ��________________________________��
(2)֤�����������˴�������������____________________________��
(3)д��(2)�з�Ӧ�Ļ�ѧ����ʽ______________________��
(4)װ��E������________________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ѧ��ȤС��Ϊ̽��������������ʣ�����ͼ��ʾװ�ý���ʵ�顣

��ش��������⣺
��1��װ��A��ʢ���������Ƶ�����������__________����Ӧ�Ļ�ѧ����ʽΪ_______________��
��2��װ��B�е�������__________________����Ӧ�����ӷ���ʽΪ_________________��
��3��װ��C�е�������____________________��������˵������������е�������________________________��
��4��װ��D��Ŀ����̽������������Ʒ�����õĿ����ԣ�д��ʵ�����������_____________��
��5��β���ɲ���__________��Һ���ա�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪2SO2��g��+ O2 ��g��![]() 2SO3 ��g������H=��197kJmol��1����ͬ�¡�ͬ����������ܱ������зֱ�������壺���ף� 2mol SO2��1mol O2�����ң� 1mol SO2��0.5mol O2�������� 2mol SO3�����¡������·�Ӧ�ﵽƽ��ʱ�����й�ϵһ����ȷ����
2SO3 ��g������H=��197kJmol��1����ͬ�¡�ͬ����������ܱ������зֱ�������壺���ף� 2mol SO2��1mol O2�����ң� 1mol SO2��0.5mol O2�������� 2mol SO3�����¡������·�Ӧ�ﵽƽ��ʱ�����й�ϵһ����ȷ����
A.������ѹǿP��P��=P����2P��
B.��Ӧ�ų���������������ֵQ��Q��=Q����2Q��
C.c��SO2����c��O2��֮��k��k��=k����k��
D.SO3������m��m��=m����2m��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com