
| A、含有0.1 mol?L-1H+的溶液中:NO3-、Na+、Cl-、Fe2+ |
| B、无色透明的溶液中:K+、Mg2+、Cl-、SO42- |
| C、强碱性溶液中:Na+、SO42-、HCO3-、K+ |
| D、能与铝反应生成H2的溶液中:Na+、Al3+、Cl-、SO42- |


科目:高中化学 来源: 题型:
| A、合成氨生产过程中将NH3液化分离,可加快正反应速率,提高N2、H2的转化率 |
| B、铁钉镀锌,将锌与电源负极相连,电镀过程需要控制电流强度、溶液pH等条件 |
| C、海轮外壳绑上锌板是采用牺牲阳极的阴极保护法,从而减缓钢铁腐蚀速率 |
| D、电解精炼铜时,阳极溶解铜的总质量和阴极析出铜的总质量相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 已知常温时CH3COOH的电离平衡常数为Ka.该温度下向20mL 0.1mol?L-1CH3COOH溶液中逐滴加入0.1mol?L-1 NaOH溶液,其pH变化曲线如图所示(忽略温度变化).下列说法中不正确的是( )
已知常温时CH3COOH的电离平衡常数为Ka.该温度下向20mL 0.1mol?L-1CH3COOH溶液中逐滴加入0.1mol?L-1 NaOH溶液,其pH变化曲线如图所示(忽略温度变化).下列说法中不正确的是( )| A、a点表示的溶液中c(CH3COO-)+c(OH-)=10-3mol?L-1 | ||
| B、b点所示的溶液中c(CH3COO-)+c(OH-)>(CH3COOH)+c(H+) | ||
| C、c点的含义为:CH3COOH和NaOH恰好反应完全 | ||
D、a、b、c、d点表示的溶液中
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、蒸发 | B、萃取 | C、过滤 | D、蒸馏 |
查看答案和解析>>
科目:高中化学 来源: 题型:
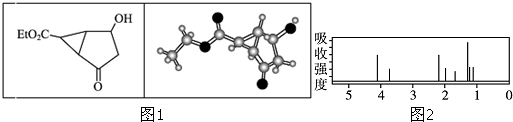
| A、该有机物不同化学环境的氢原子有6种 |
| B、该有机物属于芳香化合物 |
| C、键线式中的Et代表的基团为-CH3 |
| D、该有机物在一定条件下能够发生消去反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
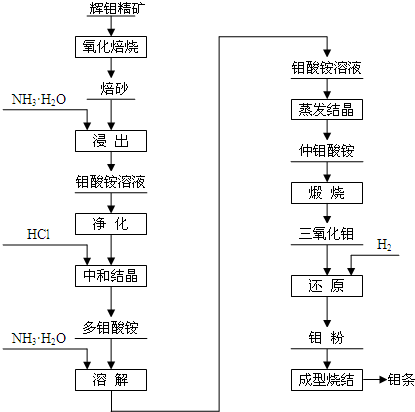
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、将稀氨水逐滴加入稀硫酸中,当溶液pH=7时,c(SO42-)=c(NH4+) |
| B、两种醋酸溶液的物质的量浓度分别c1和c2,pH分别为a和a+1,则c1<10c2 |
| C、室温下,pH=11的NaOH溶液与pH=3的醋酸溶液等体积混合,溶液呈酸性 |
D、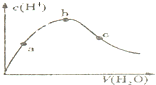 向冰醋酸中逐渐加水,有如图变化.a、b、c三点中水的电离程度最大的是b点 |
查看答案和解析>>
科目:高中化学 来源: 题型:
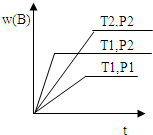 已知某反应aA(g)+bB(g)?cC(g)△H=Q 在密闭容器中进行,在不同温度(T1和T2 )及压强(P1 和P2 )下,混合气体中B的质量分数w(B)与反应时间(t)的关系如图所示,下列判断正确的是( )
已知某反应aA(g)+bB(g)?cC(g)△H=Q 在密闭容器中进行,在不同温度(T1和T2 )及压强(P1 和P2 )下,混合气体中B的质量分数w(B)与反应时间(t)的关系如图所示,下列判断正确的是( )| A、T1<T2,P1<P2,a+b>c,Q>0 |
| B、T1>T2,P1<P2,a+b<c,Q<0 |
| C、T1<T2,P1>P2,a+b<c,Q>0 |
| D、T1<T2,P1>P2,a+b>c,Q<0 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、该反应中反应物总能量高于生成物的总能量 |
| B、该反应只能在较高温度下才能自发进行 |
| C、该反应在较低温度下能自发进行,高温和催化剂条件只是加快反应的速率 |
| D、汽车尾气中的这两种气体会与人体血红蛋白结合而使人中毒 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com