
分析 A元素的最高正化合价和最低负化合价的代数和等于0,且A是形成化合物种类最多的元素,故A是碳元素;
C原子能形成分别含10电子、18电子的两种阴离子,故C为氧元素,能形成氧离子和过氧根离子,分别为10电子和18电子;
A、B、C原子序数依次递增,故B为氮元素;
C与F位于同一主族,那么F为硫元素;
G也为短周期元素,故G应为氯元素;
E的简单阳离子是同周期元素所形成的简单离子中半径最小的,故E为铝元素;
D单质投入冷水中反应缓慢,投入沸水中迅速产生气泡,且D原子序数小于Al,故D为镁元素,
(1)B为氮元素,处于第二周期第VA族;
(2)元素M位于Al与S元素之间,且M单质是优良的半导体材料,广泛用于太阳能电池,故M为硅元素,元素的非金属性越强,其气态氢化物越稳定,由于非金属性Cl>S>Si,故氢化物稳定性:HCl>H2S>SiH4;
(3)硝酸酸性强于碳酸,故硝酸与碳酸钠反应放出二氧化碳气体,碳酸酸性强于硅酸,故碳酸与硅酸钠反应生成难溶于水的硅酸;
(4)A、两者均为排在H之前的活泼金属,金属性强的与稀硫酸反应放出氢气快;
B、铝为两性单质,能与氢氧化钠反应放出氢气,镁不能与氢氧化钠副反应放出氢气;
C、Mg和Al均不是变价元素,故与氧气、氯气、硫反应产物均只有一种;
解答 解:A元素的最高正化合价和最低负化合价的代数和等于0,且A是形成化合物种类最多的元素,故A是碳元素;
C原子能形成分别含10电子、18电子的两种阴离子,故C为氧元素,能形成氧离子和过氧根离子,分别为10电子和18电子;
A、B、C原子序数依次递增,故B为氮元素;
C与F位于同一主族,那么F为硫元素;
G也为短周期元素,故G应为氯元素;
E的简单阳离子是同周期元素所形成的简单离子中半径最小的,故E为铝元素;
D单质投入冷水中反应缓慢,投入沸水中迅速产生气泡,且D原子序数小于Al,故D为镁元素,
(1)B为氮元素,处于第二周期第VA族,故答案为:二;ⅤA;
(2)元素M位于Al与S元素之间,且M单质是优良的半导体材料,广泛用于太阳能电池,故M为硅元素,元素的非金属性越强,其气态氢化物越稳定,由于非金属性Cl>S>Si,故氢化物稳定性:HCl>H2S>SiH4,
故答案为:HCl>H2S>SiH4;
(3)硝酸酸性强于碳酸,故硝酸与碳酸钠反应放出二氧化碳气体,化学反应方程式为:Na2CO3+2HNO3═2NaNO3+CO2↑+H2O,碳酸酸性强于硅酸,故碳酸与硅酸钠反应生成难溶于水的硅酸,化学反应方程式为:Na2SiO3+H2O+CO2═H2SiO3↓+Na2CO3,
故答案为:Na2CO3+2HNO3═2NaNO3+CO2↑+H2O;Na2SiO3+H2O+CO2═H2SiO3↓+Na2CO3;
(4)A、两者均为排在H之前的活泼金属,金属性强的与稀硫酸反应放出氢气快,故A正确;
B、铝为两性单质,能与氢氧化钠反应放出氢气,镁不能与氢氧化钠副反应放出氢气,此不能说明金属活泼性,故B错误;
C、Mg和Al均不是变价元素,故与氧气、氯气、硫反应产物均只有一种,不能说明金属活泼性,故C错误,
故选A,
故答案为:A.
点评 本题以元素的推断为载体,主要考查的是金属性与非金属性强弱比较、电子式的书写、元素所在周期表位置的判断等,综合性较强,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
 .
. .
. ,其晶体类型属于分子晶体,④与⑥形成的原子个数比为1:1的化合物的电子式是
,其晶体类型属于分子晶体,④与⑥形成的原子个数比为1:1的化合物的电子式是 ,其晶体类型属于离子晶体.
,其晶体类型属于离子晶体.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 容器 | 温度/k | 物质的起始浓度/mol•L-1 | 物质的平衡浓度/mol•L-1 | ||
| c(H2) | c(CO) | c(CH3OH) | c(CH3OH) | ||
| Ⅰ | 400 | 0.20 | 0.10 | 0 | 0.080 |
| Ⅱ | 400 | 0.40 | 0.20 | 0 | |
| Ⅲ | 500 | 0 | 0 | 0.10 | 0.025 |
| A. | 该方应的正反应吸热 | |
| B. | 达到平衡时,容器Ⅰ中反应物转化率比容器Ⅱ中的大 | |
| C. | 达到平衡时,容器Ⅱ中c(H2)大于容器Ⅲ中c(H2)的两倍 | |
| D. | 达到平衡时,容器Ⅲ中的反应速率比容器Ⅰ中的大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
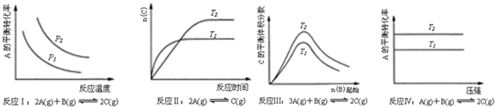
| A. | 反应Ⅰ:△H>0,P2>P1 | B. | 反应Ⅱ:△H<0,T1>T2 | ||
| C. | 反应Ⅲ:△H<0,T2>T1 | D. | 反应Ⅳ:△H<0,T2>T1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
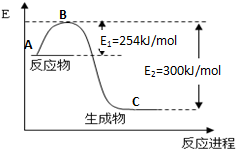 到目前为止,由化学能转变的热能或电能仍然是人类使用最广泛的能源.
到目前为止,由化学能转变的热能或电能仍然是人类使用最广泛的能源.| 化学键 | H-H | N≡N |
| 键能(kJ/mol) | 435 | 943 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若a=b,则容器中可能使用了催化剂或恒温恒容下充入惰性气体 | |
| B. | 在该温度下,保持容积固定不变,向容器内补充了B气体,则a<b | |
| C. | 若其他条件不变,升高温度,则a<b | |
| D. | 若保持温度、压强不变,充入惰性气体,则a>b |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在标准状况下,1mol水的体积是22.4L | |
| B. | 1molH2所占的体积一定是22.4L | |
| C. | 在标准状况下,NA个任何分子所占的体积约为22.4L | |
| D. | 在标准状况下,质量为28g的CO气体,其体积约为22.4L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2,2-二甲基-1-丁醇与2-甲基-2-丁醇互为同分异构体 | |
| B. |  的核磁共振氢谱有5个峰 的核磁共振氢谱有5个峰 | |
| C. | 根据核磁共振氢谱能鉴别1-溴丙烷和2-溴丙烷 | |
| D. | 用KMnO4酸性溶液能鉴别CH3CH═CHCH2OH和CH3CH2CH2CHO |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com