
【题目】如图是从小白菊中提取的一种有机物。下列关于该有机物的说法正确的是
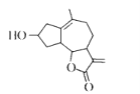
A.可在酸件或碱性溶液中稳定存在
B.其同分异构体存在芳香族化合物
C.能使溴水或酸性KMnO4溶液褪色,其原理相同
D.分子中所有原子一定在同一平面内
 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源: 题型:
【题目】下列有关同分异构体数目的叙述不正确的是
A.甲苯苯环上的一个氢原子被含3个碳原子的烷基取代,所得产物有6种
B.分子式为C4H8Cl2的有机物共有8种
C.含有5个碳原子的某饱和链烃,其一氯取代物可能有3种
D.菲的结构简式为![]() ,它与硝酸反应,可生成 5种一硝基取代物
,它与硝酸反应,可生成 5种一硝基取代物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积为2L的密闭容器中发生反应xA(g)+yB(g)zC(g)。图甲表示200℃时容器中A、B、C物质的量随时间的变化,图乙表示温度100℃和200℃平衡时C的体积分数随起始n(A):n(B)的变化关系.则下列结论正确的是( )
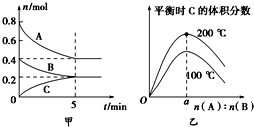
A.200℃时,反应从开始到平衡的平均速率v(B)=0.04molL-1min-1
B.200℃时,该反应的平衡常数为25L2/mol2
C.当外界条件由200℃降温到100℃,原平衡一定被破坏,且正逆反应速率均增大
D.由图乙可知,反应xA(g)+yB(g)zC(g)的△H<0,且a=2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子在给定条件下一定能大量共存的是
A.强酸性溶液中:H+、NO![]() 、SO
、SO![]()
B.pH=12的溶液中:OH-、K+、Cl-、HCO![]()
C.加入铝粉能放出氢气的溶液中一定存在:NH![]() 、NO
、NO![]() 、AlO
、AlO![]() 、SO
、SO![]()
D.25C时pH=7的无色溶液中:Na+、Cl-、SO![]() 、K+
、K+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下 ,下列各组离子在指定溶液中能大量共存的是
A.0.1 mol L-1的盐酸:Na+、Cu2+、SO![]() 、NO
、NO![]()
B.0. 1 mol L-1的氨水:K+、Al3+、Cl、CH3COO-
C.0. 1 mol L-1的Fe(NO3)3溶液: H+、K+、Cl-、I-
D.0.1 mol L -1的Na2SO3溶液:NH![]() 、Na+、ClO-、SO
、Na+、ClO-、SO![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】环戊二烯基铁[ Fe(C5H5)2]是一种有机过渡金属化合物,常温下为橙黄色粉末,难溶于水,易溶于有机溶剂,温度超过100 °C能够升华,实验室制备环戊二烯基铁的装置和步骤如下:
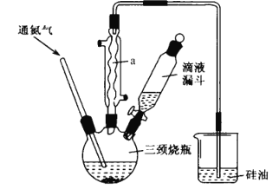
实验步骤:
步骤1:在三颈烧瓶中加入10mL乙二醇二甲醚(作溶剂)和4. 5 g研细的 KOH 粉末,通入氮气并开启磁力搅拌器 ,然后加入1. 5mL环戊二烯(过量);
步骤2:将1.5g FeCl24H2O溶于5 mL二甲基亚砜中 ,并转入滴液漏斗中,将步骤1中的混合物猛烈搅拌10 min,打开滴液漏斗将氯化亚铁的二甲基亚砜溶液在45 min钟左右滴完;
步骤3:关闭滴液漏斗,在氮气保护下继续搅拌30 min;
步骤4:将反应后的混合液倒入100 m L烧杯内,加入少量盐酸除去剩余的KOH,再加入20mL 水,继续搅拌悬浊液15min,抽滤产物,并用水洗涤产物3~4次,最后将产物铺在面皿上,置于真空干燥器内干燥。回答下列问题:
(1)仪器a的作用是___________________。
(2)制备过程中若不通入氮气,会降低环戊二烯基铁的产率,试分析其中的原因: __________。
(3)硅油的主要作用是______。
(4)步骤4中分离环戊二烯基铁也可采用如下方法,请将分离步骤补充完整:向反应后的混合液加入10 mL乙醚(ρ= 0.71g cm-3 ) 充分搅拌,然后转入_____(填仪器名称)中,依次用盐酸、水各洗涤两次,待液体分层后_____________(填完整操作过程),将含有二环戊二烯基合铁的溶液在通风橱中蒸发得到二环戊二烯基合铁粗产品。
(5)可采用如图所示的简易装置分离提纯环戊二烯基铁。将颗粒状环戊二烯基铁放入蒸发皿中并小火加热,环戊二烯基铁在扎有小孔的滤纸上凝结,该分离提纯方法的名称是_______________,装置棉花的作用是___________。
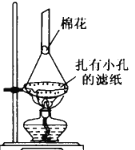
(6)若最终制得环戊二烯基铁质量为 0.16g,则产率为_____%(保留一位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NM-3和D-58是正处于临床试验阶段的小分子抗癌药物,结构如下:
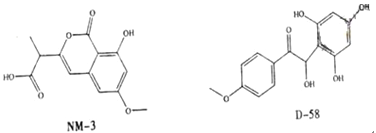
关于NM-3和D-58的叙述,错误的是
A.都能与![]() 溶液反应,原因不完全相同
溶液反应,原因不完全相同
B.都能与溴水反应,原因不完全相同
C.都不能发生消去反应,原因相同
D.遇![]() 溶液都显色,原因相同
溶液都显色,原因相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是
A.铜溶于氯化铁浓溶液中:Cu + Fe3+=Cu2+ + Fe2+
B.NH4HCO3溶液中加入过量氢氧化钠稀溶液:NH![]() + OH- =NH3·H2O
+ OH- =NH3·H2O
C.碳酸银溶于稀硝酸:Ag2CO3 + 2H+ =2Ag++ CO2↑+ H2O
D.铝粉投入到NaOH溶液中:2Al+2OH-=2AlO![]() +H2↑
+H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】298K时用0.05mol·L-1氨水滴定20mL0.05mol·L-1的叠氮酸(HN3)溶液,滴定过程中混合溶液的电阻率变化情况如图所示,已知NH3·H2O的电离常数Kb=1.7×10-5,HN3的电离常数Ka=1.9×10-5.下列说法中错误的是
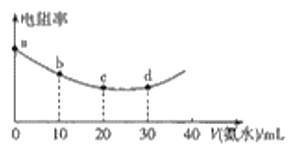
A.电阻率与离子浓度和离子所带电荷有关
B.a、b、c、d四点中,水的电离程度最大的是c
C.c~d之间可能存在:c(N3-)=c(NH4+)>c(H+)=c(OH-)
D.若用0.05mol·L-1HN3溶液滴定20mL0.05mol·L-1氨水,则所得曲线完全相同
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com