

 .
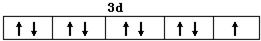
.分析 (1)Cu2+的价层电子数是9个,所以Cu2+的价电子为3d9;
(2)SO32-离子的价层电子对数=3+$\frac{1}{2}$(6+2-3×2)=4;
(3)由流程图可知向Cu(NH3)4SO4水溶液中通入SO2时生成白色沉淀,根据所给沉淀的化学式书写离子方程式;
(4)a.氨气极易溶于水,是因为NH3分子和H2O分子之间形成2种不同的氢键,N与H,O与H之间;
b.NH3分子和H2O分子,分子空间构型不同,氨气是三角锥型,水是角形,氨气分子的键角大于水分子的键角;
c. Cu(NH3)4SO4所含有的化学键有离子键、极性共价键和配位键,硫酸根离子与配离子之间是离子键,N与H之间是共价键,氨气与铜离子之间是配位键;
d. NH3的VSEPR模型为三角锥形,SO42-的VSEPR模型为正四面体;
(5)由图可知,该晶胞中亚铁离子个数=8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,氧离子个数=1+12×$\frac{1}{4}$=4,
设晶胞边长为a cm,晶胞体积为a3cm3,结合ρ=$\frac{m}{V}$计算.
解答 解:(1)Cu2+的价层电子数是9个,所以Cu2+的价电子排布图为 ,
,
故答案为: ;
;
(2)SO32-离子的价层电子对数=3+$\frac{1}{2}$(6+2-3×2)=4,所以中心原子的杂化方式为sp3杂化;
故答案为:sp3杂化;
(3)由流程图可知向Cu(NH3)4SO4水溶液中通入SO2时生成白色沉淀,根据所给沉淀的化学式书写离子方程式,所以离子方程式为:2Cu(NH3)42++3SO2+4H2O=2NH4CuSO3↓+6NH4++SO42-;
故答案为:2Cu(NH3)42++3SO2+4H2O=2NH4CuSO3↓+6NH4++SO42-;
(4)a.氨气极易溶于水,是因为NH3分子和H2O分子之间形成2种不同的氢键,N与H,O与H之间,故a正确;
b.NH3分子和H2O分子,分子空间构型不同,氨气是三角锥型,水是角形,氨气分子的键角大于水分子的键角,故b错误;
c. Cu(NH3)4SO4所含有的化学键有离子键、极性共价键和配位键,硫酸根离子与配离子之间是离子键,N与H之间是共价键,氨气与铜离子之间是配位键,故c正确;
d. NH3的VSEPR模型为三角锥形,SO42-的VSEPR模型为正四面体,故d错误,
故答案为:ac;
(5)由图可知,该晶胞中亚铁离子个数=8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,氧离子个数=1+12×$\frac{1}{4}$=4,
设晶胞边长为a cm,晶胞体积为a3cm3,则ρ=$\frac{\frac{72g/mol×4}{N{\;}_{A}}}{a{\;}^{3}cm{\;}^{3}}$=$\frac{288}{a{\;}^{3}.N{\;}_{A}}$g/cm3,
故答案为:$\frac{288}{a{\;}^{3}.N{\;}_{A}}$g/cm3.
点评 本题考查制备实验及晶胞计算,为高频考点,把握物质结构与性质、晶胞计算方法等为解答的关键,侧重分析与应用能力的考查,题目难度不大.


 全优冲刺100分系列答案
全优冲刺100分系列答案 英才点津系列答案
英才点津系列答案 红果子三级测试卷系列答案
红果子三级测试卷系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铁与盐酸反应:2Fe+6H+=2Fe3++H2↑ | |
| B. | 氢氧化钠溶液与盐酸反应:OH-+H+=H2O | |
| C. | 锌与硫酸铜溶液反应:Zn+Cu2+=Zn2++Cu | |
| D. | 氯化钡溶液与稀硫酸反应:Ba2++SO42-=BaSO4↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 从海带中提取碘的过程中得到碘的四氯化碳溶液,可用蒸发的方法分离出碘 | |
| B. | 利用二氧化碳等原料合成的聚碳酸酯类可降解塑料有利于减少白色污染 | |
| C. | 绿色化学的核心是应用化学原理对环境污染进行治理 | |
| D. | 控制雾霾需要从控制氮氧化物、二氧化硫和二氧化碳等大气污染物排放着手 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 ;
;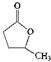 、HOOCCH2CH2CH2CHO
、HOOCCH2CH2CH2CHO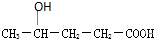 $?_{△}^{浓H_{2}SO_{4}}$CH3-CH=CH-CH2-COOH+H2O;
$?_{△}^{浓H_{2}SO_{4}}$CH3-CH=CH-CH2-COOH+H2O; ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳酸氢钡溶液与少量NaHSO4溶液反应:HSO4-+Ba2++HCO3-═BaSO4↓+H2O+CO2↑ | |
| B. | 钠和水的反应:Na+2H2O═Na++OH-+H2↑ | |
| C. | 硫酸镁溶液与氢氧化钡溶液反应:Ba2++SO42-═BaSO4↓ | |
| D. | 向碳酸氢钙溶液中滴加过量的澄清石灰水:Ca2++OH-+HCO3-═CaCO3↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳酸钙与盐酸反应:CO32-+2H+=CO2↑+H2O | |
| B. | 氨水与盐酸反应:OH-+H+=H2O | |
| C. | 氢氧化钡溶液与硫酸反应:Ba2++OH-+H++SO42-=BaSO4↓+H2O | |
| D. | 铁与氯化铁溶液反应:Fe+2Fe3+=3Fe2+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com