
【题目】下列物质中,不能使高锰酸钾酸性溶液褪色的是( )
A.乙炔
B.甲苯
C.苯
D.乙烯
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】六种短周期元素A、B、C、D、E、F的原子序数依次增大,A和D同族,C和E同族,D离子和C离子具有相同的电子层结构。A和C、E、F均能形成共价型化合物。A和C形成的化合物在水中呈碱性,D和F形成的化合物在生活中常作调味剂,A与B的核外电子数之和等于F的最外层电子数。回答下列问题:(用化学式作答)
(1)A、C、D、E四种元素原子半径的大小的顺序是____________(填元素符号);
(2)由A和E、F所形成的共价型化合物中,热稳定性由强到弱的顺序是_____;
(3)A和F形成的化合物与A和C形成的化合物反应,产物的化学式为_______,产物中存在的化学键类型为_______;
(4)E、F最高价氧化物的水化物的酸性由强到弱的顺序是__________;
(5)C、E氢化物熔沸点的大小关系是______;
(6)F的单质与D的最高价氧化物的水化物反应的离子方程式为__________。
(7)(BC)2称为拟卤素,性质与卤素相似,气体分子(BC)2的电子式为____________,其与氢氧化钠溶液反应的化学方程式为_________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜、铬都是用途广泛的金属.工业上利用电镀污泥(主要含有Fe2O3、CuO、Cr2O3及部分难溶杂质)回收金属铜和铬的流程如图: 
已知:部分物质沉淀的pH如表:
Fe3+ | Cu2+ | Cr3+ | |
开始沉淀pH | 2.1 | 4.7 | 4.3 |
完全沉淀pH | 3.2 | 6.7 | a |
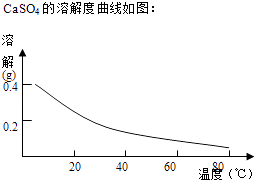
请回答下列问题:
(1)滤液I中所含溶质主要有(填化学式).
(2)第②步操作中,先加人Ca(OH)2调节溶液的pH,调节范围为 , 然后将浊液加热至80℃趁热过滤,所得滤渣Ⅱ的成分为 .
(3)当离子浓度≤1×10﹣5molL﹣1时,可以认为离子沉淀完全.第④步操作中,若要使Cr3+完全沉淀,则室温下溶液中a的最小值为 . (已知:Kap[Cr(OH)3]=6.3×10﹣31 , ![]() ≈4.0;lg4=0.6)
≈4.0;lg4=0.6)
(4)Cr(OH)3受热分解为Cr2O3 , 用铝热法可以冶炼金属铬.写出铝热法炼铬的化学方程式 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生用0.1000 molL﹣1KOH液滴定未知浓度的醋酸,其操作分解为如下几步: A.移取20mL待测醋酸注入洁净的锥形瓶,并加入2~3滴指示剂
B.用标准溶液润洗滴定管2~3次
C.把盛有标准溶液的碱式滴定管固定好,调节滴定管尖嘴使之充满溶液
D.取标准KOH入碱式滴定管至“0”刻度以上1~2cm
E.调节液面至“0”或“0”以下某一刻度,记下读数
F.把锥形瓶放在滴定管的下面,用标准KOH溶液滴定至终点并记下滴定管液面的刻度.
就此实验完成填空:
(1)正确操作步骤的顺序是(用序号字母填写);
(2)上述B步骤操作的目的是;
(3)上述A步骤操作之前,先用待测液润洗锥形瓶,则对最终滴定结果的影响是 . (填“增大”、“减小”、或“不变”)
(4)A步骤中,使用的指示剂为 , 判断到达滴定终点的实验现象是:;
(5)如图1为某一次碱式滴定管滴定前液面,其读数值为mL,图2为滴定结束液面,则本次滴定过程共使用了mLKOH标准溶液 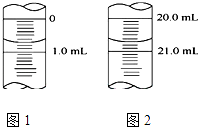
(6)为标定某醋酸溶液的准确浓度,用0.1000molL﹣1的NaOH溶液对20.00mL醋酸溶液进行滴定,几次滴定消耗NaOH溶液的体积如下:
实验序号 | 1 | 2 | 3 | 4 |
消耗NaOH溶液的体积(mL) | 20.05 | 20.00 | 18.80 | 19.95 |
则该醋酸溶液的准确浓度为 . (保留小数点后四位)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由硫酸钾、硫酸铝和硫酸组成的混合溶液,其中c(H+)=0.1molL-1,c(Al3+)=0.4molL-1,c(SO42-)=0.8molL-1.则c(K+)为( )
A. 0.15molL-1 B. 0.2molL-1 C. 0.3molL-1 D. 0.4molL-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Science 杂志在2017年春节发表了南京理工大学的论文,报道了世界上首个成功合成的五氮阴离子盐 (N5)6(H3O)3(NH4)4Cl(白色固体),这是全氮含能材料中里程碑式的突破。该盐可简略表示如下,下列分析不合理的是( )
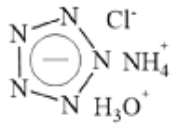
A. 五氮阴离子的化学式为 ![]() B. 该盐中氮元素的化合价均为-3价
B. 该盐中氮元素的化合价均为-3价
C. 该盐遇强碱能释放出NH3 D. 该盐中五氮阴离子具有还原性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学用如图所示装置制备并检验Cl2的性质.下列说法正确的是( ) 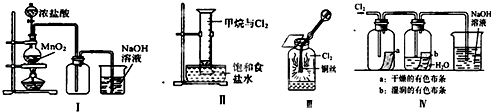
A.Ⅰ图中:如果MnO2过量,浓盐酸就可全部被消耗
B.Ⅱ图中:量筒中发生了加成反应
C.Ⅲ图中:生成蓝色的烟
D.Ⅳ图中:湿润的有色布条能褪色,将硫酸溶液滴入烧杯中,至溶液显酸性,结果有Cl2生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是( )
A.硝酸钾溶液能导电,所以硝酸钾溶液是电解质
B.石墨有较好的导电性,所以石墨属于电解质
C.液态氯化氢、固态氯化钠均不能导电,所以氯化氢、氯化钠均不是电解质
D.蔗糖在水溶液中和熔融状态下均不能导电,所以蔗糖是非电解质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁酸钾(K2FeO4)是一种集氧化、吸附、絮凝于一体的新型多功能水处理剂.其生产工艺如下: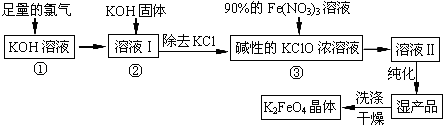
(1)反应①应在温度较低的情况下进行.因在温度较高时KOH 与Cl2 反应生成的是KClO3 . 写出在温度较高时KOH 与Cl2反应的化学方程式 , 该反应的氧化产物是 .
(2)在溶液Ⅰ中加入KOH固体的目的是(填编号).
A.与溶液Ⅰ中过量的Cl2继续反应,生成更多的KClO
B.KOH固体溶解时会放出较多的热量,有利于提高反应速率
C.为下一步反应提供碱性的环境
D.使KClO3转化为 KClO
(3)从溶液Ⅱ中分离出K2FeO4后,还会有副产品KNO3、KCl,则反应③中发生的离子反应方程式为 .
(4)如何判断K2FeO4晶体已经洗涤干净 .
(5)高铁酸钾(K2FeO4)具有极强的氧化性,是一种优良的水处理剂.FeO42﹣在水溶液中的存在形态如图Ⅱ所示.下列说法正确的是(填字母). 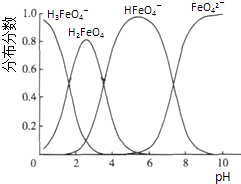
A.不论溶液酸碱性如何变化,铁元素都有4种存在形态
B.向pH=2的这种溶液中加KOH溶液至pH=10,HFeO4﹣的分布分数先增大后减小
C.向pH=8的这种溶液中加KOH溶液,发生反应的离子方程式为:H2FeO4+OH﹣═HFeO4﹣+H2O.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com