
【题目】以某铬矿石(主要成分是Cr2O3 , 含FeO、SiO2等杂质)为原料生产Cr2O3的流程如下: 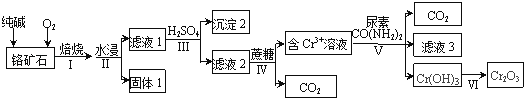
已知:Cr2O72﹣+H2O2CrO42﹣+2H+ , Ksp[Cr(OH)3]=6.4×10﹣31 , lg2=0.3
(1)步骤Ⅰ中为了提高反应速率应该采取的措施有、 . (写2种)
(2)滤液1中的阴离子除CO32﹣外,主要还有、 .
(3)步骤Ⅳ发生的反应中Cr2O72﹣和蔗糖(C12H22O11)的物质的量之比为 .
(4)步骤Ⅴ中为了使Cr3+完全沉淀[此时,c(Cr3+)≤10﹣5molL﹣1],pH至少调至 .
(5)滤液3的主要溶质是两种盐,化学式为 .
(6)研究发现,固态Na2CrO4与氨气在500℃下反应得到NaCrO2 , 将NaCrO2溶解后通入CO2得到更为纯净的Cr(OH)3 . 则NaCrO2溶液与过量CO2反应的离子方程式为 .
【答案】
(1)适当升温;粉碎铬矿石
(2)CrO42﹣;SiO32﹣
(3)8:1
(4)5.6
(5)(NH4)2SO4、Na2SO4
(6)CrO2﹣+CO2+2H2O=Cr(OH)3↓+HCO3﹣
【解析】以铬矿石(主要成分是Cr2O3 , 含FeO、SiO2等杂质)为原料,加入碳酸钠和氧气高温灼烧发生反应,二氧化硅能与碳酸钠反应生成硅酸钠,FeO被氧化为氧化铁,水浸过滤分离,结合滤液2与蔗糖得到Cr3+、信息Cr2O72﹣+H2O2CrO42﹣+2H+ , 可知滤液1中含有Na2CrO4、Na2SiO3、未反应的Na2CO3 , 过滤得到滤渣为氧化铁,调节溶液pH使硅酸根转化为硅酸沉淀,再过滤除去,得到滤液2中含有Na2Cr2O7、Na2SO4 , 用蔗糖还原,再与尿素反应,滤液3的主要溶质是两种盐为(NH4)2SO4、Na2SO4 . (1)适当升温、粉碎铬矿石、搅拌等等可以反应速率,
所以答案是:适当升温、粉碎铬矿石、搅拌等;(2)滤液1中含有Na2CrO4、Na2SiO3、Na2CO3等,除CO32﹣外,主要还有:CrO42﹣、SiO32﹣ ,
所以答案是:CrO42﹣、SiO32﹣;(3)反应中Cr元素化合价由+6价降低为+3价,C元素由0价升高为+4,根据电子转移守恒则:6n(Cr2O72﹣)=48n(蔗糖),故n(Cr2O72﹣):n(蔗糖)=8:1所以答案是:8:1;(4)Cr3+沉淀完全的浓度为10﹣5mol/L,根据KSP[Cr(OH)3]=c(Cr3+)×c3(OH﹣)=6.4×10﹣31 , 可知c(OH﹣)=4×10﹣9mol/L,则c(H+)= ![]() mol/L=
mol/L= ![]() ×10﹣5mol/L,则pH=﹣lg
×10﹣5mol/L,则pH=﹣lg ![]() ×10﹣5=5.6,所以答案是:5.6;(5)滤液3的主要溶质是两种盐是(NH4)2SO4、Na2SO4 , 所以答案是:(NH4)2SO4、Na2SO4;(6)将NaCrO2溶解后通入CO2得到更为纯净的Cr(OH)3 , 属于水解反应,还生成碳酸氢钠,反应离子方程式为:CrO2﹣+CO2+2H2O=Cr(OH)3↓+HCO3﹣ , 所以答案是:CrO2﹣+CO2+2H2O=Cr(OH)3↓+HCO3﹣ .
×10﹣5=5.6,所以答案是:5.6;(5)滤液3的主要溶质是两种盐是(NH4)2SO4、Na2SO4 , 所以答案是:(NH4)2SO4、Na2SO4;(6)将NaCrO2溶解后通入CO2得到更为纯净的Cr(OH)3 , 属于水解反应,还生成碳酸氢钠,反应离子方程式为:CrO2﹣+CO2+2H2O=Cr(OH)3↓+HCO3﹣ , 所以答案是:CrO2﹣+CO2+2H2O=Cr(OH)3↓+HCO3﹣ .


 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案科目:高中化学 来源: 题型:
【题目】(15分)某科研小组采用如下方案回收一种光盘金属层中的少量Ag(金属层中其他金属含 量过低,对实验的影响可忽略).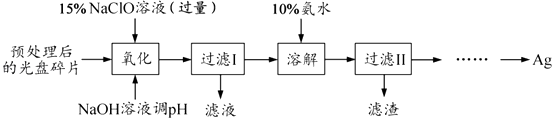
已知:①NaClO溶液在受热或酸性条件下易分解,如 3NaClO═2NaCl+NaClO3
②AgCl可溶于氨水 AgCl+2NH3H2OAg(NH3)2++Cl﹣+2H2O
③常温时 N2H4H2O(水合肼)在碱性条件下能还原 Ag(NH3)2+:
4Ag(NH3)2++N2H4H2O═4Ag↓+N2↑+4NH4++4NH3↑+H2O
(1)“氧化”阶段需在 80℃条件下进行,适宜的加热方式为 .
(2)NaClO 溶液与 Ag 反应的产物为 AgCl、NaOH 和 O2 , 该反应的化学方程式为 . HNO3也能氧化Ag,从反应产物的角度分析,以HNO3代替NaClO的缺点是 .
(3)为提高Ag的回收率,需对“过滤Ⅱ”的滤渣进行洗涤,并 .
(4)若省略“过滤Ⅰ”,直接向冷却后的反应容器中滴加10%氨水,则需要增加氨水的用量,除因过量NaClO与NH3H2O反应外(该条件下NaClO3与NH3H2O不反应),还因为 .
(5)请设计从“过滤Ⅱ”后的滤液中获取单质Ag的实验方案:(实验中须使用的试剂有:2molL﹣1水合肼溶液,1molL﹣1H2SO4 ).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是
A. 在任何分子中都含有化学键
B. 形成离子键的阴阳离子间只存在静电吸引力
C. CO2、PCl3分子中所有原子都满足最外层8电子稳定结构
D. D2O与H2O所含电子总数不相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合F是一种重要的有机合成中间体,它的合成路线如下: 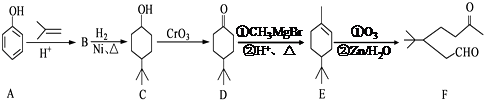
请认真分析和推理回答下列问题:
(1)由B生成C的化学反应类型是;化合物F中含氧官能团的名称是;
(2)写出化合物C与乙酸反应生成酯的化学方程式: .
(3)写出化合物B的结构简式: . 同时满足下列条件的B的同分异构体(不包括B)共有种: ①苯环上只有两个取代基 ②能与FeCl3溶液显紫色.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列热化学方程式中的反应热为可燃物的燃烧热的是[ ]
A.H2(g)+1/2O2(g)=H2O(g) △H =-241.8kJ·mol—1
B.CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H =-846.3kJ·mol—1
C.C(s)+O2(g)=CO2(g) △H =-393.5kJ·mol—1
D.C3H8(g)+5O2(g)=3CO(g)+4H2O(l)△ H = -2044.0kJ·mol—1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于萃取操作的说法正确的是( )
A. 从碘水中萃取碘,可用酒精作萃取剂
B. 萃取操作完成后,静置分层,上下层液体依次从下口放出
C. 用一种有机溶剂,提取水溶液中的某物质,静置分层,“水层”应在上层
D. 萃取时所选溶剂应与原溶剂互不相溶,且与溶质不反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于化学键的说法不正确的是
A. 化学键是一种作用力
B. 化学键可以使离子相结合,也可以使原子相结合
C. 化学反应过程中,反应物分子内的化学键断裂,产物中的化学键形成
D. 极性键、非极性键和氢键等都属于共价键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 凡是金属元素跟非金属元素形成的化合物都是离子化合物
B. 氢键是化学键的一种
C. 第ⅠA族和第ⅦA族原子化合时,一定生成离子键
D. 离子化合物中可能存在共价键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面是几种烃的球棍模型(灰球表示碳原子,氢原子省略):
(1)属于烷烃的有(填字母)。
(2)分子中氢原子数最少的是(填字母)。
(3)上面模型中最多有种烃互为同分异构体。
(4)属于烯烃的是 , 并写出其结构简式:。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com