
| A、He | B、Li | C、Si | D、Ge |
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、小苏打溶液中加入少量的澄清石灰水:HCO3-+Ca2++OH-═CaCO3↓+H2O |
| B、磁性氧化铁在盐酸中长期浸泡:Fe3O4+8H+=2Fe3++Fe2++4H2O |
| C、向Ca(ClO)2溶液中通入过量的CO2:Ca2++2ClO-+CO2+H2O=CaCO3↓+2HClO |
| D、向FeO中加入足量稀硝酸:FeO+2H+=2Fe2++H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在化学反应过程中,发生物质变化的同时不一定发生能量变化 |
| B、反应产物的总焓大于反应物的总焓时,反应吸热,△H>0 |
| C、破坏生成物全部化学键所需要的能量大于破坏反应物全部化学键所需要的能量时,反应为吸热反应 |
| D、△H的大小与热化学方程式的计量数无关 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 ,下列叙述不正确的是( )
,下列叙述不正确的是( )| A、反应①中Cl2既作氧化剂又作还原剂 |
| B、反应②中ClO3-作氧化剂 |
| C、两个反应均为氧化还原反应 |
| D、反应②中的离子方程式为:ClO3-+Cl-+6H+=Cl2↑+3H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、非金属性:A>C |
| B、原子半径:B<C<D |
| C、最高价氧化物对应水化物的酸性:D<C |
| D、单质B常温下能溶于浓硝酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:
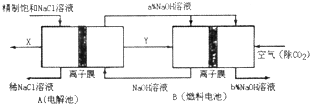
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、反应需25秒达平衡,反应达平衡以E表示反应速率为0.01mol/(L?s) |
| B、若维持其它条件不变,向上述容器中起初加入2.0molM,反应建立平衡,M的转化率为50% |
| C、若维持其它条件不变,再向上述反应平衡中分别加入0.5molE,0.5molM,则平衡向右移动 |
| D、若上述容器为绝热容器,则反应达平衡速率比原平衡速率增大,M浓度也增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、室温下,pH=1的盐酸中:Na+、Fe3+、NO3-、SO42- |
| B、强碱性溶液中:K+、Mg2+、Cl-、SO42- |
| C、含有Ca2+的溶液中:Na+、K+、CO32-、Cl- |
| D、由水电离产生的c(H+)=1×10-13mol/L的溶液中:Na+、K+、SiO32-、Cl- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com