
| A. | 标准状况下,22.4LHF中含有的分子数目为NA | |
| B. | .1 L 0.1mol/L 的FeCl3溶液中,Fe3+的数目为0.1NA | |
| C. | .标准状况下,2.24LCl2溶于水,转移的电子数目为0.1NA | |
| D. | .5.6gFe在0.1molCl2中充分燃烧,转移的电子数目为0.2NA |
分析 A、标况下HF为液态;
B、铁离子是弱碱阳离子;
C、氯气和水的反应为可逆反应;
D、求出铁的物质的量,然后根据1molFe~$\frac{3}{2}$molCl2来分析.
解答 解:A、标况下HF为液态,故不能根据气体摩尔体积来计算其物质的量,故A错误;
B、铁离子是弱碱阳离子,在溶液中会水解,故溶液中的铁离子的个数小于0.1NA个,故B错误;
C、氯气和水的反应为可逆反应,不能完全反应,故转移的电子数小于0.1NA个,故C错误;
D、5.6g铁的物质的量为0.1mol,而1molFe~$\frac{3}{2}$molCl2,故0.1mol氯气要想反应完全,需要0.15mol氯气,故铁过量,氯气能完全反应,由于氯气反应后变为-1价,故0.1mol氯气转移0.2mol电子即0.2NA个,故D正确.
故选D.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 闻名世界的中国陶瓷、酿酒等技术都充分应用了化学工艺 | |
| B. | 四大发明之一黑火药是由硫黄、硝石、木炭三种物质按一定比例混合制成 | |
| C. | 侯氏制碱法的工艺过程中应用了物质溶解度的差异 | |
| D. | 打磨磁石制作指南针为化学变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

| 沉淀物 | 开始沉淀 | 完全沉淀 |
| Al(OH)3 | 3.8 | 5.2 |
| Fe(OH)3 | 2.7 | 3.2 |
| Fe(OH)2 | 7.6 | 9.7 |
| Ni(OH)2 | 7.1 | 9.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用SiO2制备硅酸不可能一步完成 | |
| B. | 使用澄清的石灰水可以鉴别Na2CO3和NaHCO3两种白色固体 | |
| C. | 把铁粉和铜粉放入FeCl3溶液充分反应后有固体剩余,固体中可能有铜无铁 | |
| D. | 烧碱溶液应保存在塞有橡胶塞的细口玻璃瓶中 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
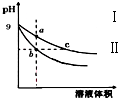 常温下,相同pH的氢氧化钠和醋酸钠溶液加水稀释,平衡时pH随溶液体积变化的曲线如图所示,则下列叙述正确的是( )
常温下,相同pH的氢氧化钠和醋酸钠溶液加水稀释,平衡时pH随溶液体积变化的曲线如图所示,则下列叙述正确的是( )| A. | b、c两点溶液的导电能力相同 | |
| B. | a、b、c三点溶液中水的电离程度a>c>b | |
| C. | c点溶液中c (H+)=c (OH-)+c (CH3COOH) | |
| D. | 用等浓度的盐酸分别与等体积的b、c处溶液恰好完全反应,消耗盐酸体积 Vb=Vc |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 人类历史上使用最早的合金是青铜 | |
| B. | 目前世界上用量最大的合金是钢 | |
| C. | 改变原料的配比、改变生成合金的条件,可以得到具有不同性质的合金 | |
| D. | 一般合金的熔点高于它的各成分金属 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应每脱去1mol Cl2会生成1molSO42- | |
| B. | 脱氯反应后的溶液显酸性 | |
| C. | 根据该反应可判断还原性:S2O32->Cl- | |
| D. | 反应中硫元素发生了氧化反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com