
【题目】高能锂离子电池总反应式为2Li+FeS=Fe+Li2S,LiPF6·SO(CH3)2为电解质,用该电池为电源电解含镍酸性废水并得到单质Ni的实验装置如图所示。下列说法正确的是
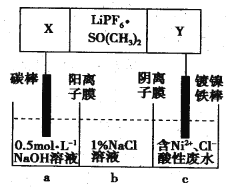
A. LiPF6·SO(CH3)2可用Li2SO4水溶液代替
B. 当转移1mol e-时,b室离子数增加NA个
C. 该电池充电时阳极反应式为Fe+Li2S-2e-=FeS+2Li+
D. 若去除图阴离子膜,则电解反应总方程式发生改变
科目:高中化学 来源: 题型:
【题目】药物Z可用于治疗哮喘、系统性红斑狼疮等,可由X(咖啡酸)和Y(1,4-环己二酮单乙二醇缩酮)为原料合成(如下图)。
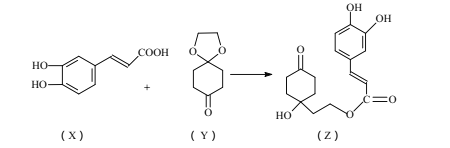
试填空:
(1)X的分子式为 _____ ;该分子中最多共面的碳原子数为 ____ 。
(2)Y中是否含有手性碳原子______(填“是”或“否”)。
(3)Z能发生 ____ 反应。(填序号)
A.取代反应 B.消去反应 C.加成反应
(4)1molZ与足量的氢氧化钠溶液充分反应,需要消耗氢氧化钠 ______mol;1molZ与足量的浓溴水充分反应,需要消耗Br2 _____ mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外兴趣小组设计利用废旧干电池中的锌皮和未知浓度的稀盐酸制取纯净、干燥的氢气,并验证气体中是否含有杂质。实验装置图如图:
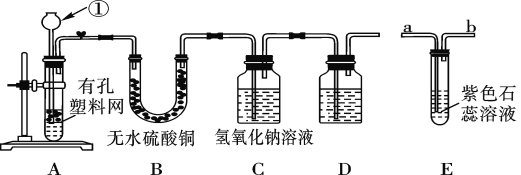
(查阅资料)无水硫酸铜遇水变蓝色。
(1)装置A中仪器①的名称是____;写出发生反应的化学方程式:___。
(2)实验中看到B中无水硫酸铜变蓝色,说明产生的气体中含有杂质水。为了检验气体中还可能存在的杂质,可将E装置连接到上述装置____(填序号)之间,气体从____(填“a”或“b”) 进入装置E。
(3)D装置中的试剂是_____(写出名称)。
(4)下列收集氢气的方法中符合题意的是_____。
A.排水法 B.向下排空气法 C.干瘪的塑料袋 D.塑料瓶
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】叠氮化钠(NaN3)常用作汽车安全气囊中的药剂。实验室制取叠氮化钠的原理、实验装置及实验步骤如下:
①打开装置D导管上的旋塞,加热制取氨气。
②再加热装置A中的金属钠,使其熔化并充分反应后,再停止加热装置D并关闭旋塞。
③向装置A中b容器内充入加热介质并加热到210~220℃,然后通入N2O。
④冷却,向产物中加入乙醇(降低NaN3的溶解度),减压浓缩结晶后,再过滤,并用乙醚洗涤,晾干。
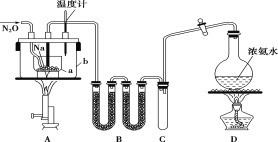
已知:I.NaN3是易溶于水的白色晶体,微溶于乙醇,不溶于乙醚;
II.NaNH2熔点210℃,沸点400℃,在水溶液中易水解。
请回答下列问题:
(1)装置B中盛放的药品为_____________;装置C的主要作用是______________________。
(2)步骤①中先加热通氨气的目的是_____________________________________;步骤②氨气与熔化的钠反应生成NaNH2的化学方程式为_______________________________。步骤③中最适宜的加热方式为 ___________(填“水浴加热”,“油浴加热”)。
(3)N2O可由NH4NO3在240~245℃分解制得(硝酸铵的熔点为169.6℃),则可选择的气体发生装置是(填序号)___________。
(4)生成NaN3的化学方程式为 _____________________________________。
(5)图中仪器a用的是铁质而不用玻璃,其主要原因是__________________。
(6)步骤④中用乙醚洗涤的主要目的是_______________________________。
(7)实验室用滴定法测定叠氮化钠样品中NaN3的质量分数:①将2.500 g试样配成500.00 mL溶液。②取50.00 mL溶液置于锥形瓶中,加入50.00 mL 0.1010 mol·L-1(NH4)2Ce(NO3)6溶液。③充分反应后,将溶液稍稀释,向溶液中加入8 mL浓硫酸,滴入3滴邻菲啰啉指示液,用0.0500mol·L-1(NH4)2Fe(SO4)2标准溶液滴定过量的Ce4+,消耗溶液体积为29.00mL。测定过程的反应方程式为:2(NH4)2Ce(NO3)6+2NaN3=4NH4NO3+2Ce(NO3)3+2NaNO3+3N2↑;Ce4++Fe2+=Ce3++Fe3+;试样中NaN3的质量分数为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
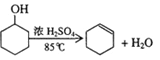
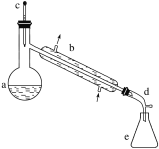
【题目】醇脱水是合成烯烃的常用方法,实验室合成环己烯的反应和实验装置如下:
可能用到的有关数据如下:
相对分子质量 | 密度/g·cm-3 | 沸点/℃ | 溶解性 | |
环己醇 | 100 | 0.961 8 | 161 | 微溶于水 |
环己烯 | 82 | 0.810 2 | 83 | 难溶于水 |
合成反应:
在a中加入20 g环己醇和2小片碎瓷片,冷却搅动下慢慢加入1 mL浓硫酸。b中通入冷却水后,开始缓慢加热a,控制馏出物的温度不超过90 ℃。
分离提纯:
反应粗产物倒入分液漏斗中分别用少量5%碳酸钠溶液和水洗涤,分离后加入无水氯化钙颗粒,静置一段时间后弃去氯化钙。最终通过蒸馏得到纯净环己烯10 g。
回答下列问题:
(1)装置b的名称是________。
(2)加入碎瓷片的作用是_____________________________________________________;
如果加热一段时间后发现忘记加瓷片,应该采取的正确操作是________(填字母,下同)。
A.立即补加 B.冷却后补加 C.不需补加 D.重新配料
(3)本实验中最容易产生的副产物的结构简式为____________________________________。
(4)分液漏斗在使用前须清洗干净并_____;在本实验分离过程中,产物应该从分液漏斗的_____(填“上口倒出”或“下口放出”)。
(5)分离提纯过程中加入无水氯化钙的目的是______________________________。
(6)在环己烯粗产物蒸馏过程中,不可能用到的仪器有________。
A.接收器 B.温度计 C.吸滤瓶 D.球形冷凝管
(7)本实验所得到的环己烯产率是________。
A.41% B.50% C.61% D.70%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1,2﹣环氧丁烷如图,通常为无色液体,用于制造泡沫塑料、合成橡胶、非离子型表面活性剂等。下列关于1,2﹣环氧丁烷的说法不正确的是( )
![]()
A. 化学式为C4H8O
B. 氧原子与所有碳原子可能处于同一平面
C. 能发生氧化反应和取代反应
D. 二溴代物的结构有9种(不考虑立体异构)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA是阿伏加德罗常数的值。下列说法正确的是
A. 常温下,11.2LSO2含有的氧原子数小于NA
B. 0. 1molNa2O2和Na2O的混合物中含有的离子总数等于0.4NA
C. 10g质量分数为34%的H2O2溶液含有的氢原子数为0.2NA
D. 100mL0.lmol/L醋酸中含有的醋酸分子数是0.0lNA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在标准状况下,有①6.72 L CO2 ②6.02×1023个HCl分子 ③0.1mol NH3 ④4g氢气,请回答:
(1)它们的体积由大到小的顺序为___________________(填写序号,下同);
(2)质量由大到小的顺序为______________________,
(3)密度由大到小的顺序为______________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com