
【题目】已知室温时,0.1mol/L某一元酸HA 在水中电离度为0.02%,回答下列各问题:
(1)该溶液中c(H+)=_________。
(2)HA的电离平衡常数K=_________;
(3)升高温度时,K_________ (填“增大”,“减小”或“不变”)。
(4)由HA电离出的c(H+)约为水电离出的c(H+)的_______倍。
【答案】2×10-5mol/L 4×10-9 增大 4×104
【解析】
根据题中一元酸HA 在水中电离度为0.02%可知,本题考查电离平衡常数的计算、温度对电离平衡的影响,运用电离平衡常数等于溶液中的电离出来的各离子浓度乘积与溶液中未电离的电解质分子浓度的比值、升高温度促进电离分析。
(1)该溶液中c(H+)=0.1mol/L×0.02%=2×10-5mol/L,
故答案为:2×10-5mol/L;
(2)HA= H++A-,则HA 电离平衡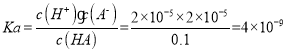
故答案为:4×10-9;
(3)一元酸HA属于弱电解质,弱电解质的电离是吸热反应,升温促进弱电解质电离,所以电离平衡常数增大。
故答案为:增大
(3)溶液中HA电离的c(H+)=2×10-5mol/L,水电离出的![]() ,所以由HA电离出的c(H+)与水电离出的c(H+)比=2×10-5mol/L: 5×10-10mol/L =4×104,
,所以由HA电离出的c(H+)与水电离出的c(H+)比=2×10-5mol/L: 5×10-10mol/L =4×104,
故答案为:4×104。


科目:高中化学 来源: 题型:
【题目】工业上由黄铜矿(主要成分CuFeS2)冶炼铜的主要流程如下:
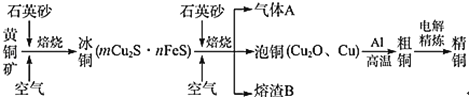
(1)气体A中的大气污染物可选用下列试剂中的_______吸收。
a.浓H2SO4 b.稀HNO3 c.NaOH溶液 d.氨水
(2)用稀H2SO4浸泡熔渣B,取少量所得溶液,滴加KSCN溶液后呈红色,说明溶液中存在_____(填离子符号),检验溶液中还存在Fe2+的方法是________________(注明试剂、现象)。
(3)由泡铜冶炼粗铜的化学反应方程式为_________________。
(4)以CuSO4溶液为电解质溶液进行粗铜(含Al、Zn、Ag、Pt、Au等杂质)的电解精炼,下列说法正确的是_________。
a.电能全部转化为化学能
b.粗铜接电源正极,发生氧化反应
c.溶液中Cu2+向阳极移动
d.阴极增加的质量一定与阳极减少的质量相同
e. 利用阳极泥可回收Ag、Pt、Au等金属
(5)利用反应2Cu+O2+2H2SO4=2CuSO4+2H2O可制备CuSO4,若将该反应设计为原电池,其正极电极反应式为______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于可逆反应mA(g)+nB(g)![]() pC(g)+qD(g)及其图象的说法正确的是( )
pC(g)+qD(g)及其图象的说法正确的是( )
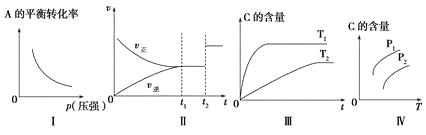
A.若图象为Ⅰ,则m+n>p+q
B.若图象为Ⅱ,则m+n=p+q,t2时刻改变的条件一定是使用催化剂
C.若图象为Ⅲ,则该可逆反应的ΔH<0
D.若图象为Ⅳ,且压强p1>压强p2,则该可逆反应的ΔH>0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科学家开发的一种“磷酸钒锂/石墨离子电池”在4.6V电位区电池总反应为:Li3C6+V2(PO4)3![]() 6C+Li3V2(PO4)3。下列有关说法正确的是
6C+Li3V2(PO4)3。下列有关说法正确的是
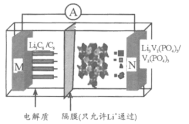
A.该电池比能量高,用Li3V2(PO4)3做负极材料
B.放电时,外电路中通过0.1 mol电子M极质量减少0.7 g
C.充电时,Li+向N极区迁移
D.充电时,N极反应为V2(PO4)3+3Li++3e-=Li3V2(PO4)3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将在某一容积为2L的密闭容器内,加入0.8mol的H2和0.6mol的I2,在一定的条件下发生如下反应:2HI(g)![]() H2(g)+ I2(g)△H> 0反应中各物质的浓度随时间变化情况如图1:
H2(g)+ I2(g)△H> 0反应中各物质的浓度随时间变化情况如图1:
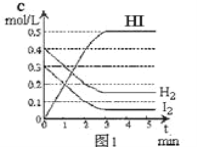
(1)该反应的化学平衡常数表达式为_________。
(2)根据图1数据,反应开始至达到平衡时,平均速率v(HI)为_________
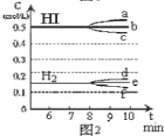
(3)反应达到平衡后,第8分钟时:
①若升高温度,化学平衡常数K_________(填写增大、减小或不变)HI浓度的变化正确_________(用图2中a-c的编号回答)
②若加入I2,H2浓度的变化正确的是_________,(用图2中d-f的编号回答)
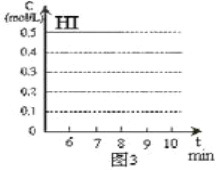
(4)反应达到平衡后,第8分钟时,若反容器的容积扩大一倍,请在图3中画出8分钟后HI浓度的变化情况___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ΔH=-49.0kJ·mol-1。一定条件下,向体积为1L的恒容密闭容器中充入1molCO2和3mol H2,测得CO2和CH3OH(g)的浓度随时间变化曲线如图所示。下列叙述中正确的是( )
CH3OH(g)+H2O(g) ΔH=-49.0kJ·mol-1。一定条件下,向体积为1L的恒容密闭容器中充入1molCO2和3mol H2,测得CO2和CH3OH(g)的浓度随时间变化曲线如图所示。下列叙述中正确的是( )

A.3min时,用CO2的浓度表示的υ(正)等于用CH3OH的浓度表示的υ(逆)
B.从0-10min,用H2表示的平均反应速率v(H2)=0.75mol·L-1·min-1
C.13min时,向容器中充入2mol氦气,该反应的化学反应速率增加
D.从反应达到平衡状态时,CO2的平衡转化率为75%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向100 mL 0.01 molL﹣1 HA溶液中逐滴加入0.02 molL﹣1的MOH溶液,图中所示曲线表示混合溶液的pH变化情况,下列说法不正确的是

A. HA为一元强酸,MOH为一元弱碱
B. N点溶液中离子浓度大小关系为:c(M+)=c(A﹣)>c(H+)=c(OH﹣)
C. N点水的电离程度大于K点水的电离程度
D. N→K之间曲线上任意一点都有c(M+) >c(OH﹣)>c(A﹣)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学电源在日常生活和高科技领域中都有广泛应用。下列说法不正确的是
A.  Zn2+向Cu电极方向移动,Cu电极附近溶液中H+浓度增加
Zn2+向Cu电极方向移动,Cu电极附近溶液中H+浓度增加
B. 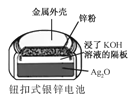 正极的电极反应式为Ag2O+2e+H2O2Ag+2OH
正极的电极反应式为Ag2O+2e+H2O2Ag+2OH
C.  锌筒作负极,发生氧化反应,锌筒会变薄
锌筒作负极,发生氧化反应,锌筒会变薄
D. 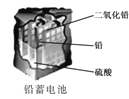 使用一段时间后,电解质溶液的酸性减弱,导电能力下降
使用一段时间后,电解质溶液的酸性减弱,导电能力下降
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于下列各图的叙述错误的是![]()
化学方程式 | 平衡常数K |
|
|
|
|
|
|
|
|
A.已知1molCO燃烧放出的热为283kJ,![]() ;
;![]() 则
则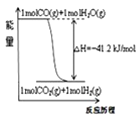 表示CO和
表示CO和![]() 生成
生成![]() 和
和![]() 的能量变化
的能量变化
B.常温下![]()
![]() HB溶液和
HB溶液和![]()
![]() 溶液等体积混合后溶液的
溶液等体积混合后溶液的![]() ,则混合溶液中离子浓度的大小顺序为:
,则混合溶液中离子浓度的大小顺序为:![]()
C.常温下,![]() 和
和![]() 反应生成HX的平衡常数如表所示,仅依据K的变化,就可以说明在相同条件下,平衡时
反应生成HX的平衡常数如表所示,仅依据K的变化,就可以说明在相同条件下,平衡时![]() 从
从![]() 到
到![]() 的转化率逐减小,且HX的还原性逐渐减弱
的转化率逐减小,且HX的还原性逐渐减弱
D.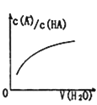 中曲线表示常温下向弱酸HA的稀溶液中加水稀释过程中,
中曲线表示常温下向弱酸HA的稀溶液中加水稀释过程中,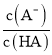 的变化情况
的变化情况
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com